Le nitrure de césium (Cs3N) est un composé inorganique composé de césium et d’azote, avec une structure cristalline en couches et une stabilité thermique élevée. Il a des applications potentielles dans des domaines tels que l’électronique, l’optoélectronique et la catalyse.
| Nom UICPA | Nitrure de césium |
| Formule moléculaire | Cs3N |
| Numero CAS | 12134-29-1 |
| Synonymes | Nitrure de tricésium |
| InChI | InChI=1S/3Cs.N/q3*+3;/p-3 |
Propriétés du nitrure de césium
Formule de nitrure de césium
La formule chimique du nitrure de césium est Cs3N, composée d’un atome de césium et de trois atomes d’azote.
Nitrure De Césium Masse molaire
La masse molaire du Cs3N est de 412,7 g/mol. Il est calculé comme la somme des masses atomiques de ses éléments constitutifs, le césium (132,905 g/mol) et l’azote (14,01 g/mol).
Point d’ébullition du nitrure de césium
Le point d’ébullition du Cs3N n’a pas été déterminé expérimentalement en raison de son instabilité et de sa tendance à se décomposer à haute température.
Point de fusion du nitrure de césium
Le point de fusion du Cs3N est estimé à environ 1000°C. Il a une structure cristalline en couches et son point de fusion dépend de ses conditions de synthèse et de la pureté du composé.
Cs3N Densité g/ml
La densité du Cs3N est estimée à environ 5,2 g/ml. Cependant, sa densité n’a pas été déterminée expérimentalement en raison de son instabilité et de sa tendance à se décomposer.
Cs3N Poids moléculaire
Le poids moléculaire du Cs3N est de 412,7 g/mol. Il est calculé comme la somme des masses atomiques de ses éléments constitutifs, le césium et l’azote.
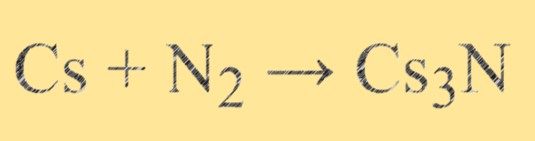
Structure du nitrure de césium
Cs3N a une structure cristalline en couches, avec des couches d’atomes de césium et d’azote empilées les unes sur les autres. C’est un composé à haute stabilité thermique et aux applications potentielles en électronique, optoélectronique et catalyse. Les détails exacts de sa structure et de ses propriétés sont toujours étudiés et analysés par les chercheurs dans le domaine.
| Apparence | Pas disponible |
| Gravité spécifique | Pas disponible |
| Couleur | Pas disponible |
| Odeur | Pas disponible |
| Masse molaire | 412,7 g/mole |
| Densité | Estimé à environ 5,2 g/ml |
| Point de fusion | Environ 1000°C |
| Point d’ébullition | Non déterminé expérimentalement |
| Point d’éclair | Pas disponible |
| Solubilité dans l’eau | Pas disponible |
| Solubilité | Pas disponible |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Remarque : Certaines valeurs sont des estimations ou ne sont pas déterminées expérimentalement en raison de l’instabilité du Cs3N et de la difficulté de manipulation du composé.
Sécurité et dangers du nitrure de césium
Le Cs3N est un composé hautement réactif et instable qui peut se décomposer à haute température. Il peut être dangereux à manipuler et des mesures de sécurité et précautions appropriées doivent être prises lorsque vous travaillez avec. L’inhalation ou l’exposition cutanée aux poussières ou aux fumées de Cs3N peuvent être toxiques et provoquer une irritation. Un stockage dans des contenants hermétiques et une élimination appropriée sont recommandés pour minimiser l’exposition potentielle et les dangers.
Méthodes de synthèse du nitrure de césium
La nitruration thermique du césium métallique dans l’azote gazeux à haute température peut synthétiser du Cs3N. Pour obtenir un produit pur et stable, la température, la pression et le débit d’azote doivent être soigneusement contrôlés. La nitruration à haute pression est une autre méthode de synthèse du Cs3N, mais elle nécessite généralement un équipement et des conditions spécialisés. Il est important de prendre en compte les propriétés et les applications souhaitées du produit final lors du choix de la méthode de synthèse à utiliser.
Utilisations du nitrure de césium
Les chercheurs étudient Cs3N pour des applications potentielles en science des matériaux. Sa grande stabilité thermique et son faible coefficient de frottement en ont fait un sujet d’étude pour son utilisation comme lubrifiant solide. Cependant, sa nature dangereuse et sa stabilité limitée rendent difficile son utilisation dans des applications pratiques. Des recherches supplémentaires sont donc nécessaires pour mieux comprendre ses propriétés et ses utilisations potentielles et pour développer des méthodes de manipulation et d’utilisation sûres.
