La nitroglycérine est un composé explosif utilisé en médecine pour traiter l’angine de poitrine. Il détend les vaisseaux sanguins, améliorant la circulation sanguine et réduisant les douleurs thoraciques. À manipuler avec une extrême prudence en raison de sa volatilité.
| Nom UICPA | Nitrate de 1,2,3-trinitrooxypropan-2-yle |
| Formule moléculaire | C3H5N3O9 |
| Numero CAS | 55-63-0 |
| Synonymes | Trinitrate de glycéryle, Trinitroglycérine, NG, Nitrospan, Nitrostat |
| InChI | InChI=1S/C3H5N3O9/c7-4(8)13-1-3(15-6(11)12)2-14-5(9)10/h3H,1-2H2 |
Propriétés de la nitroglycérine
Formule nitroglycérine
La formule de la trinitroglycérine est C3H5N3O9. Il se compose de trois atomes de carbone (C), cinq atomes d’hydrogène (H), trois atomes d’azote (N) et neuf atomes d’oxygène (O). La structure moléculaire de la trinitroglycérine est caractérisée par la présence de plusieurs groupes nitrate liés à une molécule de glycérol.
Nitroglycérine Masse molaire
La masse molaire de la trinitroglycérine est d’environ 227,09 grammes par mole. Il est calculé en additionnant les masses atomiques de chaque élément de la formule chimique (C3H5N3O9). La masse molaire joue un rôle crucial dans la détermination de la quantité de trinitroglycérine requise pour diverses applications.
Point d’ébullition de la nitroglycérine
La trinitroglycérine est un composé hautement volatil avec un faible point d’ébullition. Il bout à environ 55 degrés Celsius (131 degrés Fahrenheit). Le faible point d’ébullition permet à la trinitroglycérine de passer facilement de l’état liquide à l’état gazeux, ce qui contribue à ses propriétés explosives.
Nitroglycérine Point de fusion
Le point de fusion de la trinitroglycérine est d’environ 13 degrés Celsius (55 degrés Fahrenheit). Ce point de fusion relativement bas permet à la trinitroglycérine d’exister sous forme liquide à température ambiante. Cependant, en raison de sa sensibilité à la chaleur et aux chocs, il nécessite une manipulation prudente pour éviter une détonation accidentelle.
Densité de nitroglycérine g/mL
La densité de la trinitroglycérine est d’environ 1,6 grammes par millilitre (g/mL). Cela signifie qu’un millilitre de trinitroglycérine pèse 1,6 gramme. La densité relativement élevée de la trinitroglycérine contribue à sa stabilité et permet un stockage et un transport faciles.
Nitroglycérine Poids moléculaire
Le poids moléculaire de la trinitroglycérine est d’environ 227,09 grammes par mole. C’est la somme des poids atomiques de tous les atomes d’une molécule de trinitroglycérine. Le poids moléculaire fournit des informations importantes pour les calculs chimiques et pour déterminer la quantité de trinitroglycérine nécessaire dans diverses applications.
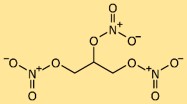
Structure de la nitroglycérine
La structure de la trinitroglycérine est constituée d’une molécule de glycérol (propane-1,2,3-triol) liée à trois groupes nitrate (-NO3). Les groupes nitrate sont attachés à différents atomes de carbone dans le squelette du glycérol. Cet arrangement moléculaire unique contribue à la nature explosive de la trinitroglycérine.
Solubilité de la nitroglycérine
La trinitroglycérine est soluble dans certains solvants organiques tels que l’éthanol, l’acétone et l’éther. Cependant, il n’est que légèrement soluble dans l’eau. Cette solubilité limitée dans l’eau rend difficile l’administration orale de la trinitroglycérine, et elle est souvent administrée par d’autres voies telles que des comprimés sublinguaux ou des patchs transdermiques à des fins médicales.
| Apparence | Liquide jaune |
| Gravité spécifique | 1,6 g/ml |
| Couleur | Jaune pâle |
| Odeur | Légère odeur |
| Masse molaire | 227,09 g/mole |
| Densité | 1,6 g/ml |
| Point de fusion | 13 °C (55 °F) |
| Point d’ébullition | 55 °C (131 °F) |
| Point d’éclair | 30 °C (86 °F) |
| Solubilité dans l’eau | Légèrement soluble |
| Solubilité | Soluble dans les solvants organiques tels que l’éthanol, l’acétone, l’éther |
| La pression de vapeur | 0,1 mmHg |
| Densité de vapeur | 8,2 (air = 1) |
| pKa | 7,7 (pKa1), 8,8 (pKa2), 9,3 (pKa3) |
| pH | Neutre |
Sécurité et dangers de la nitroglycérine
La trinitroglycérine présente des risques importants pour la sécurité en raison de sa nature explosive. Il est très sensible à la chaleur, aux chocs et à la friction, ce qui le rend extrêmement dangereux en cas de mauvaise manipulation. Il peut exploser avec une grande force, provoquant des blessures graves, voire la mort. Des protocoles de sécurité stricts doivent être suivis lors de la manipulation de la nitroglycérine, notamment le port d’un équipement de protection approprié et son stockage dans un endroit sûr, frais et sec. Il est crucial d’éviter toute étincelle, flamme nue ou source d’inflammation à proximité. Une attention particulière doit être portée au transport et au stockage pour éviter les accidents et minimiser les risques d’explosion.
| Symboles de danger | Explosif, Toxique Aigu |
| Description de la sécurité | Très explosif. Manipulez avec une extrême prudence. Évitez la chaleur, les étincelles et les flammes nues. |
| Numéros d’identification de l’ONU | UN 0143 (Liquide) |
| Code SH | 2909.10.00 |
| Classe de danger | 1.1D (Explosifs) |
| Groupe d’emballage | PG II (Danger moyen) |
| Toxicité | Toxique par ingestion ou inhalation. |
Méthodes de synthèse de nitroglycérine
Diverses méthodes peuvent synthétiser la nitroglycérine.
Une approche courante implique la réaction entre l’acide nitrique concentré (HNO3) et le glycérol (C3H8O3) . La réaction se déroule dans des conditions soigneusement contrôlées, généralement avec l’ajout d’acide sulfurique (H2SO4) comme catalyseur. Maintenir une température basse et ajouter lentement du glycérol à un mélange d’acide nitrique concentré et d’acide sulfurique pour synthétiser la nitroglycérine.
Une autre méthode implique l’utilisation d’acide mixte, qui est une combinaison d’acide nitrique et d’acide sulfurique. Ajouter du glycérol à l’acide mixte tout en contrôlant la température lors de la synthèse de la nitroglycérine.
Dans les deux méthodes, l’acide nitrique agit comme un agent oxydant, réagissant avec le glycérol pour former de la nitroglycérine. L’acide sulfurique facilite la réaction en fournissant un environnement approprié et en agissant comme catalyseur.
Il est important de noter que la synthèse de la nitroglycérine nécessite beaucoup de soin et d’expertise en raison de sa nature hautement explosive. Suivez des mesures de sécurité strictes à tout moment pour minimiser les risques d’accidents tout au long du processus.
Après la synthèse, la solution de nitroglycérine résultante est souvent purifiée par lavage et filtration pour éliminer les impuretés.
Dans l’ensemble, la synthèse de la nitroglycérine implique une série de réactions chimiques qui nécessitent un contrôle précis et le respect des protocoles de sécurité pour garantir un processus réussi et sûr.
Utilisations de la nitroglycérine
La trinitroglycérine a plusieurs utilisations importantes dans divers domaines en raison de ses propriétés uniques. Voici quelques applications clés de la nitroglycérine :
- Traitement de l’angine de poitrine : les médecins utilisent couramment la nitroglycérine en médecine pour soulager et prévenir l’angine de poitrine, une affection qui provoque des douleurs thoraciques en raison d’une réduction du flux sanguin vers le cœur. Il détend les vaisseaux sanguins, améliorant la circulation sanguine et réduisant les douleurs thoraciques.
- Explosifs : La trinitroglycérine est un ingrédient principal de nombreux explosifs. Sa puissance explosive élevée et sa sensibilité le rendent adapté aux applications telles que les opérations minières, de construction et militaires.
- Fabrication industrielle : La trinitroglycérine sert de précurseur à la synthèse d’autres composés explosifs, comme la dynamite et le TNT (trinitrotoluène). Ces substances sont largement utilisées dans les industries de la construction, des carrières et de la démolition.
- Pyrotechnie : Les feux d’artifice et les spectacles pyrotechniques utilisent de la nitroglycérine pour créer des effets visuels vibrants et éblouissants.
- Chimie analytique : les chimistes analytiques utilisent la nitroglycérine comme composé standard pour déterminer les performances et l’efficacité de divers instruments et méthodes analytiques.
- Stabilisateurs et propulseurs : il trouve une application dans les propulseurs pour fusées et missiles, fournissant la poussée nécessaire à l’exploration spatiale et aux systèmes de défense.
- Obus d’artillerie : Les fabricants incorporent de la nitroglycérine dans les obus d’artillerie pour améliorer leur puissance explosive et leur efficacité sur le champ de bataille.
- Recherche scientifique : les laboratoires utilisent la nitroglycérine à des fins de recherche, notamment pour des études sur le comportement explosif, la physique des ondes de choc et les réactions chimiques.
Les diverses utilisations de la nitroglycérine soulignent son importance dans les domaines médical, industriel et scientifique, mais avec la plus grande prudence en raison de son caractère explosif.
Des questions:
Q : À quoi sert la nitroglycérine ?
R : La trinitroglycérine détend les vaisseaux sanguins, améliore la circulation sanguine et aide à réduire les douleurs thoraciques (angine de poitrine).
Q : Qu’est-ce que la nitroglycérine ?
R : La trinitroglycérine est un composé explosif utilisé en médecine pour traiter l’angine de poitrine et dans les explosifs destinés à diverses applications industrielles et militaires.
Q : À quoi sert la nitroglycérine ?
R : La trinitroglycérine est utilisée pour traiter l’angine de poitrine, en tant que composant explosif, et dans des industries telles que l’exploitation minière, la construction et la pyrotechnie.
Q : Comment fonctionne la nitroglycérine ?
R : La trinitroglycérine agit en libérant de l’oxyde nitrique, qui détend les muscles lisses, y compris ceux des vaisseaux sanguins, entraînant une amélioration de la circulation sanguine.
Q : Comment la nitroglycérine agit-elle dans le corps ?
R : Dans le corps, la trinitroglycérine est convertie en oxyde nitrique, ce qui dilate les vaisseaux sanguins et réduit la charge de travail du cœur.
Q : Quelle liaison simple présente dans la nitroglycérine est probablement la plus courte ?
R : La liaison simple entre le carbone et l’azote (CN) dans la trinitroglycérine est probablement la plus courte.
Q : La nitroglycérine est-elle un bêtabloquant ?
R : Non, la trinitroglycérine n’est pas un bêtabloquant. Il appartient à une classe de médicaments appelés nitrates.
Q : Quelle liaison simple présente dans la nitroglycérine est la moins polaire ?
R : La liaison simple entre le carbone et le carbone (CC) dans la trinitroglycérine est la moins polaire.
Q : Comment fabriquait-on la nitroglycérine dans le Far West ?
R : Dans le Far West, la trinitroglycérine était généralement fabriquée en mélangeant du glycérol avec des acides nitrique et sulfurique concentrés dans des conditions contrôlées.
Q : Comment la nitroglycérine explose-t-elle ?
R : La trinitroglycérine explose lorsqu’elle est soumise à la chaleur, à un choc ou à une friction, entraînant une libération rapide de gaz et une augmentation considérable du volume et de la pression.
Q : Quelle est l’odeur de la nitroglycérine ?
R : La trinitroglycérine a une légère odeur, souvent décrite comme légèrement sucrée ou éthérée.
