Le nitrite de sodium (NaNO2) est un composé chimique couramment utilisé comme conservateur alimentaire pour prévenir la croissance bactérienne et rehausser la couleur et la saveur des charcuteries comme le bacon et les hot-dogs.
| Nom UICPA | Nitrite de sodium |
| Formule moléculaire | NaNO2 |
| Numero CAS | 7632-00-0 |
| Synonymes | Acide nitreux, sel de sodium ; E250 ; Natriumnitrit; Nitrite de sodium; Nitrito sodique; ONU 1500 |
| InChI | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
Propriétés du nitrite de sodium
Formule de nitrite de sodium
La formule chimique du nitrite de sodium est NaNO2. Cela indique qu’une mole de nitrite de sodium contient un cation sodium, un atome d’azote et deux atomes d’oxygène. La formule est utilisée pour représenter la composition d’une substance et peut être utilisée pour prédire les réactions qu’une substance peut subir.
Nitrite De Sodium Masse molaire
NaNo2 a une masse molaire de 69,0 g/mol. Il s’agit de la masse d’une mole de NaNo2, qui correspond à la quantité de substance contenant 6,02 x 10 ^ 23 molécules individuelles du composé. La masse molaire est une propriété physique importante utilisée pour calculer diverses propriétés chimiques et physiques d’une substance.
Point d’ébullition du nitrite de sodium
Le point d’ébullition du NaNo2 est de 320°C (608°F). C’est la température à laquelle NaNo2 passera d’un liquide à un gaz. Le point d’ébullition est une propriété importante car elle peut affecter la manière dont une substance est utilisée dans diverses applications industrielles, telles que la production de colorants, de pigments et de produits pharmaceutiques.
Nitrite de sodium Point de fusion
Le point de fusion du NaNo2 est de 271°C (520°F). C’est la température à laquelle NaNo2 passera d’un solide à un liquide. Le point de fusion est une propriété importante car elle peut affecter la stabilité et la réactivité d’une substance à différentes températures.
Densité du nitrite de sodium g/mL
La densité de NaNo2 est de 2,168 g/mL. La densité est la masse par unité de volume d’une substance et peut être utilisée pour déterminer la concentration d’une solution. La densité de NaNo2 peut également être utilisée pour déterminer la pureté d’un échantillon.
Nitrite De Sodium Poids moléculaire
Le poids moléculaire de NaNo2 est de 69,0 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule du composé. Le poids moléculaire est une propriété importante utilisée pour calculer diverses propriétés chimiques et physiques d’une substance.
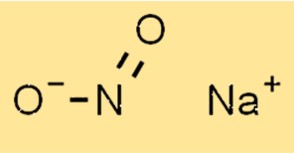
Structure du nitrite de sodium
La structure de NaNo2 est composée d’un cation sodium (Na+) et d’un anion nitrite (NO2-). L’anion nitrite a une géométrie planaire trigonale avec un atome d’azote et deux atomes d’oxygène. Le cation sodium est situé au centre de l’anion nitrite.
Solubilité du nitrite de sodium
NaNo2 est soluble dans l’eau, avec une solubilité de 820 g/L à 20°C. La solubilité est la quantité maximale d’une substance pouvant être dissoute dans une quantité donnée de solvant à une température donnée. La solubilité du NaNo2 peut être affectée par des facteurs tels que la température et la présence d’autres solutés.
| Apparence | Poudre cristalline blanche à légèrement jaunâtre |
| Gravité spécifique | 2,168 g/mL |
| Couleur | Blanc à légèrement jaunâtre |
| Odeur | Inodore |
| Masse molaire | 69,0 g/mole |
| Densité | 2,168 g/mL |
| Point de fusion | 271°C (520°F) |
| Point d’ébullition | 320°C (608°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 820 g/L à 20°C |
| Solubilité | Soluble dans l’éthanol et le glycérol |
| Pression de vapeur | 1,33 kPa à 20°C |
| Densité de vapeur | 2,3 (air = 1) |
| pKa | 3.34 |
| pH | 7-8 (solution à 10 %) |
Sécurité et dangers du nitrite de sodium
Le NaNo2 peut présenter un certain nombre de dangers pour la santé humaine et l’environnement. Il est considéré comme toxique s’il est ingéré, inhalé ou absorbé par la peau et peut provoquer une méthémoglobinémie, une condition dans laquelle le sang est incapable de transporter l’oxygène vers les tissus du corps. Le NaNo2 peut également être irritant pour les yeux, la peau et le système respiratoire. Il est important de manipuler NaNo2 avec prudence, en utilisant un équipement de protection individuelle approprié et en suivant les procédures de manipulation et d’élimination appropriées. De plus, le NaNo2 peut présenter un risque pour l’environnement s’il n’est pas correctement confiné et éliminé.
| Symboles de danger | T+,C |
| Description de la sécurité | Tenir à l’écart des matériaux combustibles. Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Porter des gants/vêtements de protection et une protection des yeux/du visage. En cas d’incendie : Utiliser du CO2, de la poudre chimique ou de la mousse pour l’extinction. Éliminer le contenu/récipient conformément aux réglementations locales/régionales/nationales/internationales. |
| Numéros d’identification de l’ONU | ONU1500 |
| Code SH | 283410 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Très toxique par ingestion, inhalation et absorption cutanée. Peut provoquer une méthémoglobinémie. Irritant pour les yeux, la peau et le système respiratoire. |
Méthodes de synthèse du nitrite de sodium
Il existe plusieurs méthodes pour synthétiser NaNo2.
Une méthode courante consiste à faire réagir l’ acide nitrique et l’hydroxyde de sodium , qui produit du nitrate de sodium. Un agent réducteur tel que le fer ou le zinc réduit le nitrate de sodium, formant ainsi NaNo2.
Une autre méthode implique la réaction du nitrate de sodium avec l’acide chlorhydrique , produisant un mélange d’ acide nitrique et de chlorure de sodium. L’hydroxyde de sodium réagit avec l’acide nitrique pour produire du NaNo2.
La synthèse de NaNo2 peut se produire par la réaction entre l’ammoniac et le nitrate de sodium , qui produit du NaNo2 et de l’eau comme produits.
Le processus de fabrication de l’acide nitrique produit du NaNo2 comme sous-produit tout en oxydant l’ammoniac au cours du processus.
Utilisations du nitrite de sodium
NaNo2 a diverses utilisations dans diverses industries, dont certaines incluent :
- Conservation des aliments : Couramment utilisé comme conservateur alimentaire, en particulier dans les charcuteries comme le bacon et les hot-dogs. Il aide à prévenir la croissance de bactéries nocives et préserve la couleur et la saveur de la viande.
- Applications industrielles : Utilisé dans diverses applications industrielles, telles que le traitement des métaux et comme inhibiteur de corrosion. Également utilisé dans la production de colorants et d’autres produits chimiques.
- Applications médicales : Utilisé en médecine pour traiter l’empoisonnement au cyanure, car il convertit l’hémoglobine en méthémoglobine, qui peut se lier aux ions cyanure et les empêcher de se lier à l’hémoglobine.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour contrôler la croissance des bactéries et des algues nocives dans les systèmes d’eau.
- Agriculture : Utilisé en agriculture comme engrais, contribuant à améliorer les rendements et la qualité des cultures.
- Photographie : Utilisé en photographie comme agent de développement.
Des questions:
Q : Qu’est-ce que le nitrite de sodium ?
R : NaNo2 est un composé chimique de formule NaNO2. Il s’agit d’une poudre cristalline blanche ou légèrement jaunâtre couramment utilisée comme conservateur alimentaire et dans diverses applications industrielles.
Q : Qui a découvert le nitrite de sodium ?
R : NaNO2 a été découvert pour la première fois en 1805 par le chimiste français Louis Nicolas Vauquelin.
Q : Le nitrite de sodium est-il mauvais pour vous ?
R : Une consommation excessive de NaNo2 peut être nocive pour la santé humaine. Il a été associé à des problèmes de santé tels que le cancer et la méthémoglobinémie, une maladie dans laquelle le sang est incapable de transporter efficacement l’oxygène. Cependant, lorsqu’il est utilisé en quantités réglementées et limitées, le NaNo2 est considéré comme sans danger pour la consommation.
Q : Quelle est la formule du nitrite de sodium ?
R : La formule du nitrite de sodium est NaNO2.
Q : Le nitrite de sodium est-il sans danger ?
R : NaNo2 est généralement considéré comme sans danger pour la consommation lorsqu’il est utilisé en quantités réglementées et limitées. Cependant, une consommation excessive peut être nocive pour la santé humaine.
Q : Comment fabriquer du nitrite de sodium ?
R : NaNo2 peut être synthétisé par diverses méthodes, telles que la réaction de l’acide nitrique et de l’hydroxyde de sodium, la réaction du nitrate de sodium avec l’acide chlorhydrique et la réaction de l’ammoniac avec le nitrate de sodium. Cependant, la synthèse de NaNo2 doit être réalisée avec prudence, car elle implique l’utilisation de produits chimiques dangereux et nécessite la prise de mesures de sécurité appropriées.
Q : Le nitrite de sodium est-il un oxydant ?
R : Oui, NaNo2 est un oxydant. Il est couramment utilisé en pyrotechnie comme agent oxydant.
Q : Comment le nitrite de sodium affecte-t-il la couleur de la viande ?
R : Le NaNO2 est couramment utilisé comme conservateur alimentaire dans les charcuteries comme le bacon et les hot-dogs. Il aide à préserver la couleur de la viande en inhibant la croissance de bactéries nocives pouvant provoquer une décoloration.
Q : Comment le NaNO2 et le NaNO3 sont-ils produits commercialement ?
R : NaNO3 et NaNO2 sont produits commercialement par diverses méthodes, telles que l’oxydation de l’ammoniac et la réaction de l’hydroxyde de sodium avec l’acide nitrique. Ils sont utilisés dans diverses applications industrielles, médicales et agricoles, ainsi que dans la conservation des aliments.
