Le nitrite de potassium (KNO2) est un composé chimique couramment utilisé comme conservateur alimentaire. Il est connu pour inhiber la croissance des bactéries et prévenir la détérioration des viandes et autres aliments.
| Nom UICPA | Nitrite de Potassium |
| Formule moléculaire | KNO2 |
| Numero CAS | 7758-09-0 |
| Synonymes | Acide nitreux, sel de potassium ; le salpêtre (III); acide nitreux, composé. avec du sel de potassium (1:1) ; E249 |
| InChI | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
Propriétés du nitrite de potassium
Formule de nitrite de potassium
La formule chimique du nitrite de potassium est KNO2. Il représente la composition du composé en termes de ses atomes constitutifs. La formule du nitrite de potassium est utilisée pour calculer sa masse molaire et son poids moléculaire.
Nitrite De Potassium Masse molaire
La masse molaire du KNO2 est de 85,103 g/mol. Il est dérivé de la somme des masses atomiques de potassium (39,10 g/mol), d’azote (14,01 g/mol) et de deux atomes d’oxygène (2 x 16,00 g/mol). La masse molaire de KNO2 est essentielle pour déterminer la quantité de substance présente dans une masse ou un volume donné.
Point d’ébullition du nitrite de potassium
Le point d’ébullition du KNO2 est de 320°C (608°F). À cette température, le composé passe d’une phase liquide à une phase gazeuse. Le point d’ébullition du KNO2 dépend de divers facteurs, tels que la pression et la pureté.
Nitrite de Potassium Point de fusion
Le point de fusion du KNO2 est de 441°C (826°F). A cette température, le composé solide se transforme en phase liquide. Le point de fusion du KNO2 est un paramètre crucial pour déterminer son adéquation à diverses applications, telles que la conservation des aliments et la médecine.
Densité du nitrite de potassium g/mL
La densité du KNO2 est de 1,915 g/mL à température ambiante. La densité d’une substance est définie comme la masse de la substance par unité de volume. La densité du KNO2 joue un rôle important dans la détermination de ses propriétés physiques, telles que sa solubilité et sa réactivité chimique.
Nitrite De Potassium Poids moléculaire
Le poids moléculaire du KNO2 est de 85,103 g/mol. C’est un paramètre crucial pour déterminer la stœchiométrie d’une réaction impliquant le KNO2. Le poids moléculaire du KNO2 est également utilisé pour déterminer ses propriétés physiques et chimiques.
Structure du nitrite de potassium
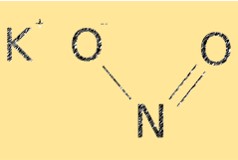
KNO2 a une formule moléculaire de KNO2. Il a une structure ionique, avec des cations potassium (K+) et des anions nitrite (NO2-). L’ion nitrite a une géométrie moléculaire courbée, avec un angle de liaison d’environ 115°. La structure du KNO2 est essentielle pour déterminer ses propriétés chimiques, telles que sa solubilité et sa réactivité.
Solubilité du nitrite de potassium
Le KNO2 est très soluble dans l’eau, avec une solubilité d’environ 710 g/L à 20°C. La solubilité du KNO2 dépend de divers facteurs tels que la température, la pression et la présence d’autres substances. La solubilité du KNO2 est un paramètre crucial pour déterminer son adéquation à diverses applications, telles que la conservation des aliments et la médecine.
| Apparence | Solide cristallin blanc à jaunâtre |
| Gravité spécifique | 1.915 |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 85,103 g/mole |
| Densité | 1,915 g/mL |
| Point de fusion | 441°C (826°F) |
| Point d’ébullition | 320°C (608°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble (710 g/L à 20°C) |
| Solubilité | Soluble dans l’éthanol, légèrement soluble dans l’ammoniac |
| La pression de vapeur | 0,0038 mmHg à 25°C |
| Densité de vapeur | 2,96 (air = 1) |
| pKa | 3.35 |
| pH | 5-8 (solution à 5 %) |
Sécurité et dangers du nitrite de potassium
Le KNO2 peut être dangereux s’il est manipulé incorrectement. Il est nocif en cas d’ingestion ou d’inhalation et peut provoquer une irritation des yeux, de la peau et du système respiratoire. Une exposition prolongée ou répétée au KNO2 peut provoquer une méthémoglobinémie, une maladie qui réduit la capacité du sang à transporter l’oxygène. Le KNO2 est également un agent oxydant puissant et peut réagir violemment avec des matériaux combustibles, provoquant un incendie ou une explosion. Des mesures de sécurité appropriées, telles que l’utilisation d’un équipement de protection, une ventilation adéquate et un stockage sûr, doivent être suivies lors de la manipulation du KNO2. En cas d’ingestion ou d’inhalation, consulter immédiatement un médecin.
| Symboles de danger | Xn |
| Description de la sécurité | S22, S24/25 |
| Numéros d’identification de l’ONU | ONU 1488 |
| Code SH | 2834.29.10 |
| Classe de danger | 5.1 |
| Groupe d’emballage | III |
| Toxicité | Nocif en cas d’ingestion ou d’inhalation, peut provoquer une méthémoglobinémie |
Méthodes de synthèse du nitrite de potassium
L’hydroxyde de potassium (KOH) réagit avec l’acide nitreux (HNO2) pour synthétiser le KNO2. La réaction produit du KNO2 et de l’eau (H2O) comme sous-produits. L’industrie utilise couramment cette méthode pour fabriquer de grandes quantités de KNO2.
L’équation de la réaction est :
2 KOH + HNO2 → KNO2 + 2 H2O
Une autre méthode pour synthétiser le KNO2 consiste à faire réagir le carbonate de potassium (K2CO3) avec l’oxyde nitrique (NO). La réaction produit du KNO2, du dioxyde de carbone (CO2) et de l’azote (N2) comme sous-produits. L’obtention d’oxyde nitrique est difficile et coûteuse, ce qui rend cette méthode moins fréquemment utilisée.
L’équation de la réaction est :
2 K2CO3 + 2 NON → 2 KNO2 + 2 CO2 + N2
On peut obtenir du KNO2 en oxydant le KNO3 à l’aide d’un agent réducteur tel que SO2 ou FeSO4.
La réaction produit du KNO2, de l’eau et la forme réduite de l’agent réducteur comme sous-produits. Les scientifiques emploient moins fréquemment cette méthode et la réservent généralement à des synthèses en laboratoire à petite échelle.
L’équation de la réaction avec le dioxyde de soufre est :
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Utilisations du nitrite de potassium
Le KNO2 a plusieurs applications industrielles et en laboratoire en raison de ses propriétés chimiques. Certaines des utilisations courantes du KNO2 sont :
- Conservation des aliments : utilisé comme conservateur dans les charcuteries pour empêcher la croissance de bactéries nocives et prolonger leur durée de conservation.
- Industrie chimique : utilisé comme intermédiaire dans la production de plusieurs produits chimiques, tels que l’acide nitreux, les composés de diazonium et les nitrites organiques.
- Agriculture : Utilisé comme engrais et amendement du sol en raison de sa haute solubilité dans l’eau et de sa capacité à libérer de l’azote.
- Réactif de laboratoire : Utilisé comme réactif dans plusieurs applications de laboratoire, telles que la détection d’amines primaires et la préparation de sels de diazonium.
- Usage médicinal : Utilisé dans le traitement de l’empoisonnement au cyanure, car il réagit avec les ions cyanure pour former de la cyanméthémoglobine non toxique.
- Photographie : Utilisé comme additif dans les développeurs photographiques pour améliorer la qualité et la clarté des images développées.
- Industrie du verre : utilisé dans l’industrie du verre comme agent décolorant pour éliminer les colorations indésirables des produits en verre.
Des questions:
Qu’est-ce que le nitrite de potassium ?
R : Le KNO2 est un composé inorganique couramment utilisé dans diverses applications industrielles et de laboratoire.
Q : Quelle est la formule du nitrite de potassium ?
R : La formule chimique du nitrite de potassium est KNO2.
Q : Quel sel est produit lorsque NH4OH réagit avec HNO3 ? KNO2, NaNO3, NH4NO3 ou NH4NO2 ?
R : Lorsque NH4OH réagit avec HNO3, le sel produit est NH4NO3.
Q : Le KNO2 est-il un acide ou une base ?
R : KNO2 est un composé basique.
Q : Quel est le nom du composé de formule KNO2 ?
R : Le nom du composé de formule KNO2 est le nitrite de potassium.
Q : KNO2 est-il une base faible ?
R : KNO2 est considéré comme une base faible.
Q : Le KNO2 est-il acide ou basique ?
R : Le KNO2 est de nature basique et peut agir comme un léger agent réducteur.
