Le nitrite de calcium (Ca(NO2)2) est un composé chimique couramment utilisé comme inhibiteur de corrosion dans le béton. Il aide à prévenir la corrosion des armatures en acier.
| Nom de l’UICPA | Dinitrite de calcium |
| Formule moléculaire | Ca(NO2)2 |
| Numero CAS | 13780-06-8 |
| Synonymes | Nitrite de calcium dihydraté, acide nitreux, sel de calcium, acide nitrique, sel de calcium, dihydraté, etc. |
| InChI | InChI=1S/Ca.2HNO2/c;2 2-1-3/h;2 (H,2,3) |
Propriétés du nitrite de calcium
Formule de nitrite de calcium
La formule chimique du nitrite de calcium est Ca(NO2)2. Cette formule indique que le composé contient deux anions nitrite pour chaque cation calcium. La formule est importante pour déterminer la composition du composé et pour déterminer la quantité de chaque élément dans le composé.
Nitrite De Calcium Masse molaire
La masse molaire du Ca(NO2)2, également connu sous le nom de dinitrite de calcium, est d’environ 132,09 g/mol. C’est un composé ionique composé de cations calcium et d’anions nitrite. La masse molaire est calculée en additionnant les masses atomiques des éléments constitutifs du composé, qui sont dans ce cas le calcium, l’azote et l’oxygène.
Point d’ébullition du nitrite de calcium
Le Ca(NO2)2 a un point d’ébullition élevé d’environ 400°C (752°F). Ce point d’ébullition élevé est dû aux fortes liaisons ioniques qui existent entre les ions Ca2+ et NO2- dans le composé. Lorsque le Ca(NO2)2 est chauffé, il subit une décomposition thermique, libérant du dioxyde d’azote et de l’oxygène.
Nitrite de calcium Point de fusion
Le Ca(NO2)2 a un point de fusion d’environ 132°C (270°F). Ce point de fusion est relativement bas comparé à d’autres composés ioniques, tels que le chlorure de sodium, qui a un point de fusion de 801°C (1 474°F). Le faible point de fusion du Ca(NO2)2 peut être attribué aux liaisons ioniques relativement faibles qui existent entre les ions Ca2+ et NO2-.
Densité du nitrite de calcium g/mL
La densité de Ca(NO2)2 est d’environ 2,32 g/mL. Cette valeur indique que Ca(NO2)2 est un composé relativement dense. La densité est calculée en divisant la masse du composé par son volume. La densité élevée de Ca(NO2)2 peut être attribuée à la présence de cations calcium, relativement lourds.
Nitrite De Calcium Poids moléculaire
Le poids moléculaire du Ca(NO2)2 est d’environ 132,09 g/mol. Cette valeur est calculée en additionnant les poids atomiques des éléments constitutifs du composé. Le poids moléculaire est important pour déterminer la quantité de Ca(NO2)2 nécessaire pour obtenir un certain nombre de moles du composé.
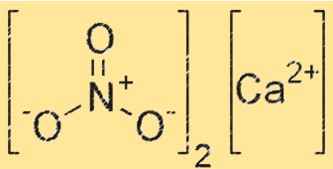
Structure du nitrite de calcium
La structure du Ca(NO2)2 est composée de Ca2+ et NO2-. Les ions Ca2+ sont situés au centre du réseau cristallin, tandis que les ions NO2- les entourent. Le réseau cristallin est maintenu ensemble par de fortes liaisons ioniques entre les ions Ca2+ et NO2-.
Solubilité du nitrite de calcium
Le Ca(NO2)2 est soluble dans l’eau et l’alcool. La solubilité dans l’eau est relativement élevée, avec une solubilité d’environ 61 g/100 ml d’eau à température ambiante. La solubilité dans l’alcool est inférieure à celle dans l’eau. La solubilité du Ca(NO2)2 est importante pour déterminer son utilisation dans diverses applications, comme dans la production de béton.
| Apparence | Poudre cristalline ou solide blanche à légèrement jaune |
| Gravité spécifique | 2.32 |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 132,09 g/mole |
| Densité | 2,32 g/ml |
| Point de fusion | 132 °C (270 °F) |
| Point d’ébullition | Se décompose à environ 400 °C (752 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau et l’alcool |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Neutre |
Sécurité et dangers du nitrite de calcium
Le Ca(NO2)2 peut être nocif s’il est ingéré, inhalé ou en contact avec la peau ou les yeux. Cela peut provoquer des irritations, des brûlures et des problèmes respiratoires. Le composé est également un agent oxydant et peut réagir avec d’autres produits chimiques, tels que des acides et des métaux, pour former des substances dangereuses. Le Ca(NO2)2 doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles. Des équipements de protection individuelle, tels que des gants et des lunettes, doivent être portés lors de la manipulation du composé. En cas d’exposition, des soins médicaux immédiats doivent être recherchés et les vêtements contaminés doivent être retirés.
| Symboles de danger | Xn |
| Description de la sécurité | Eviter le contact avec la peau et les yeux; porter un équipement de protection individuelle (EPI); en cas d’exposition, consulter immédiatement un médecin |
| Numéros d’identification de l’ONU | ONU 1454 |
| Code SH | 2834.29.90 |
| Classe de danger | 5.1 |
| Groupe d’emballage | III |
| Toxicité | Nocif en cas d’ingestion ou d’inhalation ; peut provoquer des irritations, des brûlures et des problèmes respiratoires |
Méthodes de synthèse du nitrite de calcium
Diverses méthodes peuvent synthétiser du Ca(NO2)2, notamment la réaction de l’acide nitrique ou des oxydes d’azote avec du carbonate de calcium , la réaction de l’acide nitreux ou des oxydes d’azote avec de l’hydroxyde de calcium et la réaction de l’hydroxyde de calcium ou de l’hydroxyde d’ammonium avec du nitrate de calcium.
Une méthode courante consiste à faire réagir du carbonate de calcium avec de l’acide nitrique pour produire du nitrate de calcium. Ensuite, la réaction du nitrate de calcium avec l’hydroxyde de calcium entraîne la formation de Ca(NO2)2 et de sous-produits d’oxyde de calcium.
Une autre méthode implique la réaction des oxydes d’azote avec l’hydroxyde de calcium pour produire du Ca(NO2)2 et du nitrate de calcium.
Dans une autre méthode, on peut faire réagir du nitrate de calcium avec de l’hydroxyde de calcium ou de l’hydroxyde d’ammonium pour produire du Ca(NO2)2 tout en générant du nitrate de calcium comme sous-produit.
Utilisations du nitrite de calcium
Le Ca(NO2)2 a diverses applications dans différentes industries, notamment :
- Industrie du béton : Utilisé comme additif pour le béton pour augmenter la durabilité et la résistance des structures en béton. Il agit comme un inhibiteur de corrosion en protégeant l’acier d’armature de la corrosion causée par les chlorures et autres ions agressifs.
- Agriculture : Utilisé comme engrais en agriculture pour fournir une source d’azote et de calcium aux plantes. Également utilisé comme amendement du sol pour améliorer la qualité du sol et favoriser la croissance des plantes.
- Industrie chimique : utilisé comme agent réducteur dans les réactions chimiques, ainsi que comme précurseur pour la synthèse d’autres produits chimiques tels que le nitrate de calcium et le nitrate d’ammonium et de calcium.
- Traitement des eaux usées : utilisé comme produit chimique de traitement des eaux usées pour éliminer les contaminants et réduire la concentration de substances nocives dans l’eau.
- Industrie alimentaire : utilisé comme conservateur alimentaire pour empêcher la croissance de bactéries et d’autres micro-organismes dans la viande, le poisson et d’autres produits alimentaires.
Des questions:
Q : Quelle est la formule du nitrite de calcium ?
R : La formule chimique du nitrite de calcium est Ca(NO2)2.
Q : Quelle quantité de nitrite de calcium est utilisée chaque année dans le béton ?
R : La quantité de Ca(NO2)2 utilisée chaque année dans le béton varie en fonction de l’application spécifique et de la demande du marché. Cependant, on estime que plusieurs milliers de tonnes de Ca(NO2)2 sont utilisées chaque année dans le monde comme additif pour le béton.
Q : Le nitrite de calcium est-il soluble dans l’eau ?
R : Oui, le Ca(NO2)2 est soluble dans l’eau. Il a une solubilité d’environ 167 g/L à 20°C.
Q : Le nitrite de calcium est-il un sel ?
R : Oui, Ca(NO2)2 est du sel. Un composé ionique composé de cations calcium (Ca2+) et d’anions nitrite (NO2-).
Q : Comment les solutions suivantes seraient-elles préparées ? 1,25 l d’une solution 0,775 m de Ca(NO2)2
R : Pour préparer 1,25 L d’une solution 0,775 M de Ca(NO2)2, il faudrait dissoudre environ 187,5 g de Ca(NO2)2 dans suffisamment d’eau pour obtenir un volume final de 1,25 L. Cela peut être calculé à l’aide de la formule formule : grammes de soluté = Molarité x volume (en litres) x masse molaire de soluté.
Q : Quelle est la formule du composé ionique pour le nitrite de calcium ?
R : La formule du composé ionique pour Ca(NO2)2 est Ca(NO2)2. Il est composé d’un ion calcium (Ca2+) et de deux ions nitrite (NO2-).
