Le nitrate de zinc (Zn(NO3)2) est un composé contenant des ions zinc et nitrate. Il est soluble dans l’eau et couramment utilisé dans les industries pour diverses applications, notamment comme catalyseur et dans la production de colorants et de pigments.
| Nom UICPA | Nitrate de zinc |
| Formule moléculaire | Zn(NO3)2 |
| Numero CAS | 7779-88-6 |
| Synonymes | Dinitrate de zinc, sel de zinc de l’acide nitrique, celloxane, nitrate de zinc |
| InChI | InChI=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
Propriétés du nitrate de zinc
Formule de nitrate de zinc
La formule du dinitrate de zinc est Zn(NO3)2. Il se compose d’un ion zinc (Zn2+) et de deux ions NO3- maintenus ensemble par des liaisons ioniques. La formule représente le rapport des éléments présents dans le composé.
Nitrate De Zinc Masse molaire
La masse molaire du dinitrate de zinc peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. La masse atomique du zinc (Zn) est d’environ 65,38 grammes par mole, et la masse atomique de l’azote (N) et de l’oxygène (O) dans les ions NO3- est d’environ 14,01 et 16,00 grammes par mole, respectivement. Par conséquent, la masse molaire du dinitrate de zinc est d’environ 189,38 grammes par mole.
Point d’ébullition du nitrate de zinc
Le dinitrate de zinc n’a pas de point d’ébullition spécifique puisqu’il se décompose avant d’atteindre son point d’ébullition. Cependant, lorsqu’il est chauffé, il se décompose en oxyde de zinc, dioxyde d’azote et oxygène. Cette réaction de décomposition se produit vers 140°C (284°F), libérant des fumées brunes de dioxyde d’azote.
Point de fusion du nitrate de zinc
Le point de fusion du dinitrate de zinc dépend de son état d’hydratation. La forme anhydre du dinitrate de zinc (Zn(NO3)2) fond à environ 238°C (460°F). Cependant, la forme hexahydratée (Zn(NO3)2·6H2O) a un point de fusion inférieur d’environ 36°C (97°F) car elle contient des molécules d’eau dans sa structure cristalline.
Densité du nitrate de zinc g/mL
La densité du dinitrate de zinc varie en fonction de sa concentration et de sa température. Cependant, dans des conditions standards, la densité de la forme anhydre est d’environ 2,065 grammes par millilitre (g/mL). La densité de la forme hexahydratée est légèrement plus élevée en raison de la présence de molécules d’eau.
Zinc Nitrate Poids moléculaire
Le poids moléculaire du dinitrate de zinc est calculé en additionnant les masses atomiques de ses éléments constitutifs. Le poids moléculaire du dinitrate de zinc est d’environ 189,38 grammes par mole, comme mentionné précédemment.
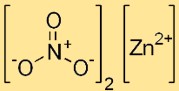
Structure du nitrate de zinc
Le dinitrate de zinc a une structure ionique, avec le cation zinc (Zn2+) entouré de six molécules d’eau sous forme hexahydratée. Les ions nitrate (NO3-) sont présents sous forme d’entités discrètes dans le réseau cristallin.
Solubilité du nitrate de zinc
Le dinitrate de zinc est très soluble dans l’eau. La solubilité augmente avec la température. À température ambiante, environ 118 grammes de dinitrate de zinc peuvent se dissoudre dans 100 grammes d’eau, ce qui donne une solution saturée.
| Apparence | Cristaux incolores |
| Gravité spécifique | 2,065 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 189,38 g/mole |
| Densité | 2,065 g/ml |
| Point de fusion | 238°C (460°F) (anhydre) |
| Point d’ébullition | Se décompose (~140°C/284°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble dans l’eau |
| Solubilité | Soluble dans l’eau |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | ~4 (solution aqueuse) |
Sécurité et dangers du nitrate de zinc
Le dinitrate de zinc présente certains risques pour la sécurité qui doivent être pris en compte. Il est important de le manipuler avec précaution pour prévenir les risques potentiels. Le contact avec le composé peut provoquer une irritation de la peau et des yeux. L’ingestion ou l’inhalation de dinitrate de zinc peut entraîner des troubles gastro-intestinaux et une gêne respiratoire. Il est conseillé d’utiliser des mesures de protection appropriées, telles que des gants et des lunettes, lorsque vous travaillez avec du dinitrate de zinc. De plus, il doit être stocké dans un endroit bien ventilé, à l’écart des substances incompatibles. En cas d’exposition ou d’ingestion accidentelle, il est recommandé de consulter un médecin. Le respect des protocoles de sécurité appropriés garantit la manipulation et l’utilisation en toute sécurité du dinitrate de zinc.
| Symboles de danger | Agent d’oxydation |
| Description de la sécurité | Provoque une irritation de la peau et des yeux. Évitez l’ingestion et l’inhalation. Manipuler avec les mesures de protection appropriées. |
| Numéros d’identification de l’ONU | No ONU 1514 (anhydre), No ONU 1515 (hexahydraté) |
| Code SH | 28342990 |
| Classe de danger | 5.1 (Substances comburantes) |
| Groupe d’emballage | II (anhydre), III (hexahydraté) |
| Toxicité | Modérément toxique |
Méthodes de synthèse du nitrate de zinc
Il existe différentes méthodes pour synthétiser le dinitrate de zinc. Une approche courante est la réaction entre le zinc métallique et l’acide nitrique . Dans cette méthode, le zinc réagit avec l’acide nitrique pour produire du dinitrate de zinc et libérer de l’hydrogène gazeux. Les opérateurs contrôlent soigneusement la réaction pour maintenir la sécurité.
Une autre méthode implique la réaction entre l’oxyde de zinc et l’acide nitrique . L’oxyde de zinc est dissous dans l’acide nitrique, conduisant à la formation de dinitrate de zinc et d’eau. Cette méthode est utile lorsque l’oxyde de zinc est facilement disponible.
De plus, le carbonate de zinc peut réagir avec l’acide nitrique pour produire du dinitrate de zinc. Le carbonate réagit avec l’acide nitrique, formant du dioxyde de carbone, de l’eau et du dinitrate de zinc.
Il est important de noter que ces réactions doivent être réalisées dans des conditions de laboratoire appropriées avec les précautions de sécurité nécessaires. Un équipement de protection approprié, tel que des gants et des lunettes, doit être porté et les réactions doivent être effectuées dans un endroit bien ventilé.
Dans l’ensemble, ces méthodes constituent des moyens efficaces de synthétiser le dinitrate de zinc, permettant ainsi son utilisation dans diverses applications industrielles.
Utilisations du nitrate de zinc
Le dinitrate de zinc trouve des applications dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques utilisations clés du dinitrate de zinc :
- Catalyseur : Le dinitrate de zinc catalyse diverses réactions chimiques, facilitant la production de colorants, de produits pharmaceutiques et de polymères.
- Galvanoplastie : Dans les processus de galvanoplastie, le dinitrate de zinc dépose une couche de zinc sur les surfaces métalliques, conférant une résistance à la corrosion et améliorant l’apparence.
- Pigments et colorants : le dinitrate de zinc agit comme un précurseur dans la production de pigments et de colorants à base de zinc, essentiels pour les peintures, les revêtements et les textiles.
- Engrais : le dinitrate de zinc sert de source de zinc dans les engrais, garantissant que les plantes reçoivent suffisamment de nutriments pour leur croissance et leur développement.
- Fabrication du verre : le dinitrate de zinc joue un rôle déterminant dans la fabrication du verre, améliorant les propriétés optiques telles que la transparence et l’indice de réfraction.
- Traitement de l’eau : Le dinitrate de zinc joue un rôle essentiel dans les systèmes de traitement de l’eau, en contrôlant la croissance des algues et des bactéries et en maintenant la qualité de l’eau.
- Réactif de laboratoire : Dans diverses expériences de laboratoire, le dinitrate de zinc fonctionne activement comme réactif, en particulier en chimie analytique et en recherche.
- Médecine et produits pharmaceutiques : Le dinitrate de zinc contribue activement à certaines formulations pharmaceutiques et médicaments topiques en raison de ses propriétés antimicrobiennes.
- Ignifuges : Le dinitrate de zinc est un composant clé des formulations ignifuges, réduisant activement l’inflammabilité des matériaux.
- Industrie textile : Dans les processus de teinture et d’impression textiles, le dinitrate de zinc améliore activement la solidité des couleurs et améliore l’absorption du colorant.
Ces diverses applications mettent en évidence l’importance du dinitrate de zinc dans de multiples industries, contribuant à une gamme de produits et de processus.
Des questions:
Q : Le nitrate de zinc est-il soluble ?
R : Oui, le dinitrate de zinc est soluble dans l’eau.
Q : Comment précipiter le carbonate de zinc à partir du nitrate de zinc ?
R : Pour précipiter le carbonate de zinc à partir de Zn(NO3)2, ajoutez une solution de carbonate de sodium ou de bicarbonate de sodium à la solution de dinitrate de zinc, ce qui entraîne la formation de carbonate de zinc sous forme de précipité.
Q : Le zinc réagit-il avec le nitrate d’argent ?
R : Oui, le Zn réagit avec le nitrate d’argent, déplaçant l’argent métallique et formant du dinitrate de zinc.
Q : Le nitrate de zinc est-il un sel ?
R : Oui, le nitrate de zinc est un sel composé de cations zinc (Zn2+) et d’ions NO3-.
Q : Que se forme lorsque le nitrate de zinc réagit avec l’hydroxyde de potassium ?
R : Lorsque le Zn(NO3)2 réagit avec l’hydroxyde de potassium, le Zn(OH)2 précipite et du nitrate de potassium se forme.
Q : Quelle est la formule du nitrate de lithium et de zinc ?
R : La formule du dinitrate de lithium et de zinc est LiZn(NO3)3.
Q : Comment normaliser la solution de nitrate de magnésium et de nitrate de zinc ?
R : Pour standardiser les solutions de nitrate de magnésium et de dinitrate de Zn, des méthodes de titrage peuvent être utilisées avec un réactif standardisé approprié.
Q : Quels sont l’acide et l’oxyde métallique utilisés pour produire du nitrate de zinc ?
R : L’acide nitrique (HNO3) et l’oxyde de zinc (ZnO) sont utilisés pour produire du dinitrate de zinc.
Q : Quels sont les produits produits lorsque du zinc est ajouté à une solution de nitrate de plomb ?
R : Lorsque du Zn est ajouté à une solution de nitrate de plomb, du dinitrate de zinc et du plomb métallique se forment.
Q : Qu’est-ce que le nitrate de zinc ?
R : Le dinitrate de zinc est un composé chimique composé de cations zinc (Zn2+) et d’anions NO3-, souvent trouvé sous forme de solide cristallin.
Q : Combien d’atomes d’oxygène y a-t-il dans 1,50 mole de Zn(NO3)2 ?
R : Dans 1,50 mole de Zn(NO3)2, il y a 9,00 moles ou 27,00 atomes d’oxygène.
Q : Quelle masse de Zn(NO3)2 doit être diluée jusqu’à une masse de 1,00 kg avec H2O pour préparer 97 ppm de Zn2+(aq) ?
R : Pour préparer une solution contenant 97 ppm de Zn2+(aq), environ 97 mg de Zn(NO3)2 doivent être dilués avec de l’eau jusqu’à obtenir une masse de 1,00 kg.
