Le nitrate de nickel (Ni(NO₃)₂) est un composé chimique contenant des ions nickel et nitrate. Il est soluble dans l’eau et souvent utilisé dans les catalyseurs, la galvanoplastie et comme précurseur dans d’autres composés de nickel.
| Nom UICPA | Dinitrate de nickel |
| Formule moléculaire | Ni(NO₃)₂ |
| Numero CAS | 13138-45-9 |
| Synonymes | Nitrate de nickel (II), nitrate de nickel, Dinitronickel, bis(nitrate) de nickel |
| InChI | InChI=1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
Propriétés du nitrate de nickel
Formule de nitrate de nickel
La formule chimique du dinitrate de nickel est Ni(NO₃)₂. Il représente un composé composé de cations nickel (Ni) et d’anions nitrate (NO₃). L’indice « 2 » dans la formule indique qu’il y a deux ions NO3- pour chaque cation Ni+2.
Nitrate De Nickel Masse molaire
La masse molaire du dinitrate de nickel peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le nickel (Ni) a une masse molaire d’environ 58,69 g/mol, tandis que le nitrate (NO₃) a une masse molaire d’environ 62,00 g/mol. En les additionnant, la masse molaire du dinitrate de nickel est d’environ 182,69 g/mol.
Point d’ébullition du nitrate de nickel
Le point d’ébullition du dinitrate de nickel fait référence à la température à laquelle il passe de l’état liquide à l’état gazeux. Le point d’ébullition du dinitrate de nickel est d’environ 136,7 degrés Celsius (278,06 degrés Fahrenheit). Il est cependant essentiel de noter que cette valeur peut varier légèrement en fonction de la pureté du composé.
Nitrate de Nickel Point de fusion
Le point de fusion du dinitrate de nickel est la température à laquelle il passe de l’état solide à l’état liquide. Le point de fusion du dinitrate de nickel est d’environ 56,7 degrés Celsius (134,06 degrés Fahrenheit). Tout comme le point d’ébullition, le point de fusion peut être influencé par la pureté du composé.
Densité du nitrate de nickel g/mL
La densité du dinitrate de nickel est une mesure de sa masse par unité de volume. Le dinitrate de nickel a une densité d’environ 1,68 g/mL. Cette valeur indique qu’elle est plus dense que l’eau, qui a une densité de 1 g/mL.
Nickel Nitrate Poids moléculaire
Le poids moléculaire du dinitrate de nickel est la somme des poids atomiques de tous les atomes présents dans sa formule chimique. Comme mentionné précédemment, le poids moléculaire du dinitrate de nickel est d’environ 182,69 g/mol.
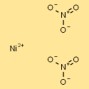
Structure du nitrate de nickel
La structure du dinitrate de nickel peut être visualisée sous forme de cations nickel (Ni²⁺) entourés de deux anions nitrate (NO₃⁻) par cation. Les ions nitrate forment des liaisons coordonnées avec les cations nickel, créant ainsi un composé ionique stable.
Solubilité du nitrate de nickel
Le dinitrate de nickel est très soluble dans l’eau et forme une solution claire bleu verdâtre. Sa solubilité dans l’eau est une propriété essentielle, car elle lui permet d’être facilement utilisé dans diverses applications, telles que les catalyseurs, la galvanoplastie et la production d’autres composés du nickel.
| Apparence | Solide bleu verdâtre |
| Gravité spécifique | 1,68 g/ml |
| Couleur | Bleu verdâtre |
| Odeur | Inodore |
| Masse molaire | 182,69 g/mole |
| Densité | 1,68 g/ml |
| Point de fusion | 56,7°C |
| Point d’ébullition | 136,7 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et les solvants organiques tels que l’éthanol |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Neutre (autour de 7) |
Veuillez noter que certaines propriétés peuvent ne pas être disponibles ou pertinentes pour le diitrate de nickel.
Sécurité et dangers du nitrate de nickel
Le dinitrate de nickel présente certains risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. Le contact direct avec le composé peut provoquer une irritation de la peau et des yeux. L’inhalation de ses poussières ou de ses fumées peut entraîner une irritation respiratoire. Il est essentiel de porter un équipement de protection approprié, tel que des gants et des lunettes de sécurité, lorsque vous travaillez avec du dinitrate de nickel. Évitez l’ingestion car cela peut être nocif pour la santé. En cas d’exposition accidentelle, consulter immédiatement un médecin. De plus, un stockage approprié dans un endroit bien ventilé, à l’écart des substances incompatibles, est crucial pour minimiser les risques potentiels et garantir une manipulation sûre.
| Symboles de danger | Corrosif, Irritant, Danger pour la santé |
| Description de la sécurité | Provoque une irritation de la peau et des yeux. Nocif en cas d’inhalation ou d’ingestion. Manipuler avec soin. Évitez les contacts directs. Utilisez un équipement de protection. |
| Numéros d’identification de l’ONU | UN2724 |
| Code SH | 2834.2990 |
| Classe de danger | 5.1 (Substances comburantes) |
| Groupe d’emballage | II |
| Toxicité | Modérément toxique |
Méthodes de synthèse du nitrate de nickel
Il existe plusieurs méthodes pour synthétiser le dinitrate de nickel. Une méthode courante implique la réaction entre l’oxyde de nickel (NiO) ou l’hydroxyde de nickel (Ni(OH)₂) avec l’acide nitrique (HNO₃). Au cours de ce processus, l’oxyde de nickel ou l’hydroxyde de nickel se dissout dans l’acide nitrique, conduisant à la formation de dinitrate de nickel et d’eau comme sous-produits.
La réaction peut prendre la représentation suivante :
- Avec oxyde de nickel : NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O
- Avec hydroxyde de nickel : Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O
Une autre approche implique la réaction entre le nickel métallique et l’acide nitrique concentré, qui entraîne la formation de dinitrate de nickel et de dioxyde d’azote gazeux (NO₂) comme sous-produit :
- Avec Nickel Métal : Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂
Il est important d’effectuer ces réactions dans des conditions bien contrôlées, car l’acide nitrique est un agent oxydant puissant et peut être dangereux. Garantissez un résultat sûr et réussi pendant le processus de synthèse en employant activement des mesures et des équipements de sécurité appropriés. De plus, le choix des réactifs et des conditions de réaction peut varier en fonction de l’application spécifique et des propriétés souhaitées du produit dinitrate de nickel.
Utilisations du nitrate de nickel
Le dinitrate de nickel trouve de multiples applications dans diverses industries en raison de ses propriétés uniques. Voici quelques-unes de ses principales utilisations :
- Galvanoplastie : Le dinitrate de nickel permet le dépôt d’une fine couche de nickel sur divers métaux, améliorant ainsi leur résistance à la corrosion et leur apparence lors des processus de galvanoplastie.
- Catalyseur : Il joue un rôle crucial de catalyseur dans les réactions chimiques, facilitant la conversion des réactifs en produits souhaités, notamment en synthèse organique.
- Céramique : L’industrie céramique utilise du dinitrate de nickel pour conférer une coloration spécifique et améliorer les performances des matériaux céramiques.
- Industrie du verre : Les fabricants de l’industrie du verre utilisent du dinitrate de nickel pour produire du verre coloré doté de propriétés optiques souhaitables.
- Production de batteries : les fabricants utilisent du dinitrate de nickel dans la production de batteries à base de nickel, y compris les batteries nickel-hydrure métallique (NiMH).
- Piles à combustible : le dinitrate de nickel agit comme précurseur dans la fabrication d’électrodes d’oxyde de nickel pour les piles à combustible à oxyde solide (SOFC).
- Pyrotechnie : En pyrotechnie, le dinitrate de nickel sert d’oxydant, produisant des flammes vertes dans les feux d’artifice.
- Réactifs chimiques : Il fonctionne comme réactif dans diverses réactions chimiques, notamment celles impliquant des complexes de nickel.
- Engrais : En agriculture, le dinitrate de nickel est utilisé occasionnellement comme source de nickel dans les engrais pour remédier aux carences en nickel de certaines cultures.
Les diverses applications du dinitrate de nickel dans différentes industries mettent en évidence son importance en tant que composé polyvalent aux utilisations pratiques très diverses.
Des questions:
Q : Lorsque des solutions de phosphate d’ammonium et de nitrate de nickel(ii) sont mélangées, qu’est-ce qui précipite ?
R : Le phosphate de nickel (II) précipite.
Q : Quelle est la molarité d’une solution contenant 5,8 grammes de nitrate de nickel dans 500 ml ?
R : La molarité est de 0,2 M.
Q : Quelles longueurs d’onde le nitrate de nickel absorbe-t-il ?
R : Le dinitrate de nickel absorbe les longueurs d’onde dans les régions ultraviolettes et visibles.
Q : Le nitrate de nickel II est-il soluble ?
R : Oui, le dinitrate de nickel(II) est soluble dans l’eau.
Q : Quelle est la formule du nitrate de nickel II ?
R : La formule est Ni(NO₃)₂.
Q : Quelle est la couleur du nitrate de nickel II ?
R : La couleur du dinitrate de nickel (II) est bleu verdâtre.
Q : Combien d’atomes d’azote y a-t-il dans la formule chimique Ni(NO₃)₂ ?
R : Il y a quatre atomes d’azote.
Q : Le Ni(NO₃)₂ est-il soluble dans l’eau ?
R : Oui, Ni(NO₃)₂ est soluble dans l’eau.
Q : Lesquels des composés C4H10, BaCl2, Ni(NO₃)₂, SF6 devraient exister sous forme d’unités de formule ?
R : C4H10 (butane) et SF6 (hexafluorure de soufre) devraient exister sous forme d’unités de formule. BaCl2 et Ni(NO₃)₂ sont des composés ioniques.
