Le nitrate de fer III est un composé chimique. Il est formé en combinant des ions fer avec des ions nitrate. Il est couramment utilisé dans les applications industrielles et comme réactif de laboratoire.
| Nom UICPA | Nitrate de fer(III) |
| Formule moléculaire | Fe(NO3)3 |
| Numero CAS | 10421-48-4 |
| Synonymes | Nitrate ferrique, trinitrate de fer, sel de fer (III) d’acide nitrique |
| InChI | InChI=1S/Fe.3NO3/c;3 2-1(3)4/q+3;3 -1 |
Propriétés du nitrate de fer (III)
Formule de nitrate de fer (III)
La formule du nitrate de fer III est Fe(NO3)3. Il se compose d’un ion fer (Fe) et de trois ions nitrate (NO3). Cette formule représente la combinaison du cation fer avec les anions nitrate.
Nitrate De Fer(III) Masse molaire
La masse molaire du nitrate de fer peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le fer (Fe) a une masse molaire de 55,845 g/mol, tandis que chaque ion nitrate (NO3) a une masse molaire de 62,0049 g/mol. L’addition de ces valeurs donne une masse molaire d’environ 241,86 g/mol pour le nitrate de fer.
Point d’ébullition du nitrate de fer (III)
Le nitrate de fer n’a pas de point d’ébullition spécifique. Lorsqu’il est chauffé, il se décompose en divers oxydes d’azote et forme finalement de l’oxyde de fer. La température de décomposition dépend de facteurs tels que la concentration et la présence d’autres substances.
Point de fusion du nitrate de fer(III)
Le point de fusion du nitrate de fer est d’environ 47 °C (117 °F). A cette température, le composé solide se transforme à l’état liquide. Il est important de noter que le point de fusion peut varier légèrement en fonction de facteurs tels que les impuretés ou la composition exacte du composé.
Densité des nitrates de fer(III) g/mL
La densité de Fe(NO3)3 est d’environ 1,68 g/mL. La densité représente la masse par unité de volume d’une substance. Dans ce cas, il indique la masse de Fe(NO3)3 par millilitre du composé.
Fer(III) Nitrate Poids moléculaire
Le poids moléculaire du nitrate de fer est d’environ 241,86 g/mol. Le poids moléculaire fait référence à la somme des poids atomiques de tous les atomes d’une molécule.
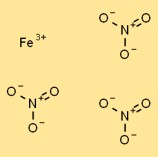
Structure du nitrate de fer (III)
Le nitrate de fer a une structure cristalline sous sa forme solide. Il se compose de cations Fe3+ entourés d’anions nitrate coordonnés (NO3-). Les cations de fer sont maintenus ensemble par des liaisons ioniques, tandis que les anions nitrate sont attirés vers les cations par des forces électrostatiques.
Solubilité des nitrates de fer (III)
Le nitrate de fer est très soluble dans l’eau. Il se dissout facilement dans l’eau pour former une solution claire et jaune pâle. La solubilité du nitrate de fer dans d’autres solvants ou substances peut varier.
| Apparence | Cristaux jaune pâle |
| Gravité spécifique | 1,68 |
| Couleur | Jaune pâle |
| Odeur | Inodore |
| Masse molaire | 241,86 g/mole |
| Densité | 1,68 g/ml |
| Point de fusion | 47 °C (117 °F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et les solvants polaires |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Acide |
Sécurité et dangers du nitrate de fer (III)
Le nitrate de fer présente certains risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. Il est considéré comme irritant pour la peau, les yeux et le système respiratoire. Le contact direct avec le composé doit être évité et des équipements de protection tels que des gants et des lunettes doivent être portés. L’ingestion ou l’inhalation de nitrate de fer peut provoquer des effets nocifs et, par conséquent, il ne doit pas être ingéré ou inhalé. Il est important de travailler avec ce composé dans un endroit bien ventilé pour minimiser le risque d’inhalation. En cas d’exposition ou d’ingestion accidentelle, des soins médicaux immédiats doivent être recherchés. Des pratiques appropriées de stockage et de manipulation doivent être suivies pour garantir la sécurité.
| Symboles de danger | Xi, O |
| Description de la sécurité | Provoque une irritation de la peau et des yeux. Peut provoquer une irritation respiratoire. Nocif en cas d’ingestion. |
| Numéros d’identification de l’ONU | UN 1466 (Anhydre) |
| Code SH | 28342990 |
| Classe de danger | 5.1 (Agent comburant) |
| Groupe d’emballage | II |
| Toxicité | Toxicité modérée |
Méthodes de synthèse du nitrate de fer (III)
On peut synthétiser le nitrate de fer par diverses méthodes, la méthode courante consistant à dissoudre l’oxyde de fer (III) (Fe2O3) dans de l’acide nitrique concentré (HNO3). Cette réaction entraîne la formation de nitrate de fer, représenté par l’équation :
L’acide nitrique concentré dissout l’oxyde de fer (III) , produisant du Fe (NO3) 3 ainsi que la production d’eau :
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
Une autre méthode consiste à combiner le fer métallique avec un mélange d’acide nitrique et de peroxyde d’hydrogène, qui oxyde le fer pour former du nitrate de fer. Cette réaction bien connue mérite le nom de méthode « à l’eau régale ».
L’ajout de fer métallique à un mélange d’acide nitrique et de peroxyde d’hydrogène conduit à la production de nitrate de fer et d’eau :
2Fe + 8HNO3 + 6H2O2 → 2Fe(NO3)3 + 6H2O.
Il est crucial de faire preuve de prudence lors de la réalisation de ces réactions en raison de la nature corrosive et oxydante des produits chimiques impliqués. Il est nécessaire de suivre les mesures de sécurité appropriées, comme porter un équipement de protection et travailler dans un endroit bien ventilé.
Des fournisseurs de produits chimiques réputés proposent du nitrate de fer disponible dans le commerce, garantissant une source constante et fiable du composé pour diverses applications dans les industries et les laboratoires.
Utilisations du nitrate de fer (III)
Le nitrate de fer a plusieurs utilisations pratiques dans diverses industries et laboratoires. Voici quelques applications clés du nitrate de fer :
- Catalyseur industriel : Plusieurs procédés industriels, notamment la production de nylon et d’autres polymères, utilisent le nitrate de fer comme catalyseur.
- Teinture et pigments : L’industrie de la teinture et de la pigmentation utilise le nitrate de fer comme mordant pour fixer les colorants sur les tissus et améliorer la solidité des couleurs.
- Agent de gravure : les industries du travail des métaux et de l’électronique utilisent le nitrate de fer comme agent de gravure pour créer des motifs et des dessins complexes sur les surfaces métalliques.
- Réactif de laboratoire : Le nitrate de fer sert de réactif de laboratoire courant pour diverses réactions et expériences chimiques, en particulier pour la synthèse d’autres composés.
- Agent oxydant : Le nitrate de fer agit comme un agent oxydant dans les réactions chimiques, y compris la synthèse organique, en raison de ses fortes propriétés oxydantes.
- Traitement de l’eau : Le nitrate de fer est utile dans les processus de traitement de l’eau pour éliminer les impuretés, telles que les phosphates et les sulfures, des eaux usées industrielles.
- Photographie : Certains procédés photographiques, notamment la préparation d’émulsions photographiques à base de fer, utilisent du nitrate de fer.
- Chimie analytique : le nitrate de fer trouve des applications dans les techniques de chimie analytique, telles que l’analyse colorimétrique, pour détecter et quantifier des substances spécifiques.
- Préservation du bois : Les traitements de préservation du bois utilisent le nitrate de fer comme ingrédient actif pour protéger le bois de la pourriture fongique et des infestations d’insectes.
- Applications pharmaceutiques : La formulation de certains produits pharmaceutiques et médicaments implique l’utilisation de nitrate de fer.
Il est important de noter que des précautions de manipulation et de sécurité appropriées doivent être suivies lorsque vous travaillez avec du nitrate de fer en raison de sa nature corrosive et oxydante.
Des questions:
Q : Le nitrate de fer(III) est-il inflammable ?
R : Non, le nitrate de fer n’est pas inflammable.
Q : Quels sont les problèmes de sécurité et de manipulation liés au nitrate de fer (III) ?
R : Les problèmes de sécurité incluent l’irritation de la peau, des yeux et des voies respiratoires. Il doit donc être manipulé avec un équipement de protection et des précautions appropriés.
Q : Quelle formule représente le nitrate de fer (III) ?
R : La formule du nitrate de fer est Fe(NO3)3.
Q : Quelle est la formule du nitrate de fer (III) ?
R : La formule du nitrate de fer(III) est Fe(NO3)3.
Q : Quelle est la masse molaire du nitrate de fer (III) ?
R : La masse molaire de Fe(NO3)3 est d’environ 241,86 g/mol.
Q : L’hydroxyde de fer est-il soluble dans l’eau ?
R : L’hydroxyde de fer est peu soluble dans l’eau.
Q : Le Ca réagit-il avec le nitrate de fer (III) ?
R : Non, le calcium (Ca) ne réagit généralement pas avec Fe(NO3)3.
Q : Avec quelle partie de l’aspirine le nitrate de fer (III) réagit-il ?
R : Le nitrate de fer (III) réagit avec le groupe carboxylate (-COO-) présent dans la molécule d’aspirine.
Q : Quelle est la masse moléculaire du nitrate de fer (III) ?
R : La masse moléculaire du Fe(NO3)3 est d’environ 241,86 g/mol.
Q : Al réagit-il avec le nitrate de fer (III) ?
R : Oui, l’aluminium (Al) peut réagir avec Fe(NO3)3 pour former du nitrate d’aluminium et du fer métallique.
Q : Combien de moles de nitrate sont dissoutes dans 50,0 g d’eau dans une solution de nitrate de fer(III) à 3,80 M ?
R : Pour déterminer les moles de nitrate, le volume de la solution est nécessaire, car seules la molarité et la masse d’eau sont fournies.
