Le nitrate de cuivre (Cu(NO3)2) est un composé cristallin bleu utilisé dans diverses industries. Il sert de catalyseur, d’agent oxydant et de précurseur pour les matériaux à base de cuivre dans les processus chimiques.
| Nom UICPA | Nitrate de cuivre(II) |
| Formule moléculaire | Cu(NO3)2 |
| Numero CAS | 3251-23-8 |
| Synonymes | Nitrate cuivrique ; Dinitrate de cuivre ; Nitrate de dicuivre ; Acide nitrique, sel de cuivre(2+) |
| InChI | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Propriétés du nitrate de cuivre
Formule de nitrate de cuivre
La formule chimique du nitrate cuivrique est Cu(NO3)2. Cela indique que chaque molécule de nitrate cuivrique contient un ion cuivre (Cu) et deux ions nitrate (NO3). La présence d’ions cuivre (II) dénote un état d’oxydation +2 du cuivre.
Nitrate De Cuivre Masse molaire
La masse molaire du nitrate cuivrique peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le cuivre (Cu) a une masse molaire d’environ 63,55 g/mol, tandis que le nitrate (NO3) a une masse molaire d’environ 62,00 g/mol. Ainsi, la masse molaire du nitrate cuivrique est d’environ 187,55 g/mol.
Point d’ébullition du nitrate de cuivre
Le point d’ébullition du nitrate cuivrique fait référence à la température à laquelle il passe de l’état liquide à l’état gazeux sous pression atmosphérique standard. Le point d’ébullition du nitrate cuivrique est généralement supérieur à 100°C (212°F). Cependant, il est important de noter que le nitrate cuivrique se décompose généralement avant d’atteindre son point d’ébullition.
Point de fusion du nitrate de cuivre
Le point de fusion du nitrate cuivrique est la température à laquelle il passe de l’état solide à l’état liquide. Le point de fusion du nitrate cuivrique se situe généralement entre 256°C et 260°C (493°F et 500°F). Il est essentiel de manipuler cette substance avec précaution pour éviter sa décomposition.
Densité du nitrate de cuivre g/mL
La densité du nitrate cuivrique fait référence à sa masse par unité de volume. La densité du nitrate cuivrique solide est généralement d’environ 2,32 g/mL, tandis que la densité de ses solutions aqueuses peut varier en fonction de la concentration.
Nitrate De Cuivre Poids moléculaire
Le poids moléculaire du nitrate cuivrique est la somme des poids atomiques de tous les atomes de sa formule chimique. Pour Cu(NO3)2, le poids moléculaire est d’environ 187,55 g/mol.
Structure du nitrate de cuivre
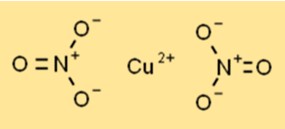
Le nitrate cuivrique existe sous la forme d’un solide cristallin bleu avec une structure cristalline hexagonale. Chaque ion cuivre (Cu2+) est entouré de six atomes d’oxygène provenant de deux ions nitrate, créant un arrangement coordonné. La structure contribue à sa stabilité et à sa réactivité dans divers processus chimiques.
Solubilité du nitrate de cuivre
Le nitrate cuivrique est modérément soluble dans l’eau. Il forme une solution aqueuse lorsqu’elle est dissoute dans l’eau, qui peut être utilisée dans diverses applications telles que la galvanoplastie et comme réactif dans des réactions chimiques. Cependant, sa solubilité diminue avec les températures plus basses.
| Apparence | Solide cristallin bleu |
| Gravité spécifique | N / A |
| Couleur | Bleu |
| Odeur | Inodore |
| Masse molaire | 187,55 g/mole |
| Densité | 2,32 g/mL (solide) |
| Point de fusion | 256-260°C (493-500°F) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Modérément soluble, forme une solution aqueuse |
| Solubilité | Soluble dans l’eau |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | Acide |
Sécurité et dangers du nitrate de cuivre
Le nitrate cuivrique pose certains problèmes de sécurité et de dangers. Il est essentiel de manipuler ce composé avec prudence. Le contact direct avec la peau ou les yeux peut provoquer des irritations ou des brûlures. L’inhalation de poussières ou de fumées peut entraîner une irritation respiratoire. Lorsqu’il est chauffé, il peut libérer des oxydes d’azote toxiques. La substance est également un agent oxydant et peut enflammer des matériaux inflammables au contact. Un équipement de protection approprié, comme des gants et des lunettes, doit être porté lorsque vous travaillez avec du nitrate de cuivre. Il doit être stocké à l’écart des matériaux combustibles et des substances incompatibles afin de minimiser les risques potentiels. Suivez toujours les consignes de sécurité et utilisez-le dans un endroit bien ventilé.
| Symboles de danger | Agent comburant, Corrosif, Irritant |
| Description de la sécurité | Manipulez avec prudence. Eviter le contact avec la peau et les yeux. Utiliser dans un endroit bien ventilé. Tenir à l’écart des matériaux combustibles. |
| Numéros d’identification de l’ONU | UN3085 |
| Code SH | 28342910 |
| Classe de danger | 5.1 (Agent comburant) |
| Groupe d’emballage | III |
| Toxicité | Nocif en cas d’ingestion. Peut provoquer une irritation de la peau et des yeux. L’inhalation de poussières ou de fumées peut provoquer une irritation respiratoire. |
Méthodes de synthèse du nitrate de cuivre
Il existe plusieurs méthodes pour synthétiser le nitrate cuivrique.
Une approche courante implique la réaction entre l’oxyde de cuivre (CuO) ou l’hydroxyde de cuivre (Cu(OH)2) avec l’acide nitrique (HNO3) . Lors de la préparation du nitrate cuivrique, on peut ajouter lentement de l’oxyde cuivrique ou de l’hydroxyde cuivrique à une solution d’acide nitrique, ce qui conduit à la formation de nitrate cuivrique et d’eau.
Une autre méthode implique la réaction entre le cuivre métallique (Cu) et l’acide nitrique concentré. Le métal Cu réagit avec l’acide nitrique pour produire du nitrate cuivrique, du dioxyde d’azote (NO2) et de l’eau. Cette méthode nécessite une manipulation prudente en raison de la formation de dioxyde d’azote gazeux toxique.
Alternativement, vous pouvez dissoudre le cuivre métallique ou l’oxyde cuivrique dans un mélange d’acide nitrique et de peroxyde d’hydrogène (H2O2) pour produire du nitrate cuivrique. Cette méthode permet une réaction plus rapide et donne du nitrate de cuivre pur.
Enfin, la réaction de double déplacement entre CuSO4 et le nitrate de sodium (NaNO3) peut également produire du nitrate cuivrique. En mélangeant ces deux sels dans l’eau, le nitrate cuivrique précipite et le sulfate de sodium, sous-produit, reste dissous.
Suivez les précautions de sécurité pendant la synthèse car les produits chimiques impliqués présentent une réactivité. Utilisez un équipement de protection approprié et utilisez des pratiques de laboratoire appropriées pour garantir une synthèse réussie et sûre du nitrate de cuivre.
Utilisations du nitrate de cuivre
Le nitrate de cuivre trouve diverses applications dans différentes industries en raison de ses propriétés uniques. Certaines utilisations notables incluent :
- Catalyseur : Il agit comme un catalyseur dans la synthèse organique, facilitant des réactions comme la conversion des alcools en aldéhydes ou en cétones.
- Pyrotechnie : Le nitrate de cuivre est un composant clé des formulations pyrotechniques, contribuant aux couleurs bleues et vertes des flammes.
- Agriculture : En agriculture, il sert de source de cuivre dans les engrais pour fournir les nutriments essentiels aux plantes.
- Agent oxydant : Le nitrate de cuivre oxyde activement d’autres substances lors des processus chimiques.
- Placage métallique : le nitrate de cuivre dépose activement une fine couche de Cu sur diverses surfaces métalliques lors des processus de galvanoplastie.
- Pigments et colorants : Le nitrate de cuivre contribue activement à la création de pigments verts et bleus pour la céramique, le verre et les textiles.
- Procédés photographiques : le nitrate de cuivre contribue activement au développement de l’image dans certaines solutions photographiques.
- Préservation : Il trouve une application dans la préservation du bois en aidant à la fixation des conservateurs.
- Préparation d’autres composés du cuivre : Il sert de précurseur pour la synthèse de divers matériaux et composés à base de cuivre.
La polyvalence et la réactivité du nitrate de cuivre en font un produit chimique précieux dans différents domaines, allant des procédés industriels aux applications artistiques.
Des questions:
Q : Que se passe-t-il lorsque le nitrate de cuivre est chauffé ?
R : Lorsqu’il est chauffé, le nitrate cuivrique se décompose en oxyde cuivrique, dioxyde d’azote gazeux et oxygène.
Q : Le nitrate de cuivre est-il soluble dans l’eau ?
R : Oui, le nitrate cuivrique est modérément soluble dans l’eau.
Q : Quelle est la formule chimique du nitrate de cuivre ?
R : La formule chimique du nitrate cuivrique est Cu(NO3)2.
Q : Le nitrate de cuivre est-il un électrolyte puissant ?
R : Oui, le nitrate cuivrique est un électrolyte puissant, qui se dissocie en ions lorsqu’il est dissous dans l’eau.
Q : Quelle est la charge du nitrate de cuivre ?
R : Le nitrate de cuivre a une charge nette de 0 ; c’est un composé neutre.
Q : Combien d’atomes d’azote y a-t-il dans 10,2 g de nitrate de cuivre(II) ?
R : Il y a environ 0,161 mole de nitrate cuivrique (II), et donc environ 0,322 mole d’atomes d’azote.
Q : Quelle masse d’argent peut être produite à partir de 3,00 moles de cuivre et de 3,85 moles de nitrate d’argent ?
R : 342,3 g d’argent peuvent être produits, en suivant l’équation chimique équilibrée.
Q : Le nitrate de cuivre est-il soluble ?
R : Oui, le nitrate cuivrique est soluble dans l’eau.
Q : Quelle est la formule du nitrate de cuivre (II) ?
R : La formule du nitrate cuivrique (II) est Cu(NO3)2.
Q : Que produit la réaction de remplacement du Cu(NO3)2 et du Zn ?
R : Le nitrate de zinc (Zn(NO3)2) et le métal cuivrique (Cu) sont produits lors de la réaction de remplacement.
Q : Qu’est-ce que Cu(NO3)2 ?
R : Cu(NO3)2 est la formule chimique du nitrate cuivrique, un composé cristallin bleu.
Q : Lequel des éléments suivants est réduit dans la réaction suivante ? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
R : Le cuivre (Cu) est réduit au cours de la réaction, gagnant des électrons pour former du cuivre métallique.
Q : Est-ce qu’un Cu(OH)2 solide se forme lorsque 0,075 g de KOH est dissous dans 1,0 L de Cu(NO3)2 1,0 × 10⁻³ M ?
R : Non, le Cu(OH)2 solide ne se forme pas puisque le Cu(NO3)2 s’ionise complètement en solution et qu’il y a un excès d’ions OH⁻ provenant de KOH.
