Le nitrate de baryum (Ba(NO3)2) est un solide blanc. Il se dissout dans l’eau et forme des ions baryum et nitrate. Il peut exploser lorsqu’il est chauffé ou mélangé à des combustibles.
| Nom de l’UICPA | Dinitrate de baryum |
| Formule moléculaire | Ba(NO3)2 |
| Numero CAS | 10022-31-8 |
| Synonymes | Nitrate de baryum, Bariumdinitrat, Dinitrate de baryum, CQ9625000, (nitrooxy)bario nitrate |
| InChI | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Propriétés du nitrate de baryum
Formule de nitrate de baryum
La formule moléculaire du nitrate de baryum est Ba(NO3)2. Il montre qu’une molécule de nitrate de baryum est constituée d’un atome de baryum et de deux molécules de nitrate. L’ion nitrate a une charge de -1 et l’ion baryum a une charge de +2, ils se combinent donc dans un rapport 1:2 pour former un composé neutre.
Nitrate De Baryum Masse molaire
La masse molaire de Ba(NO3)2 est 261,337 g/mol. C’est la masse d’une mole de molécules Ba(NO3)2. Pour le calculer, il faut additionner les masses atomiques de tous les atomes de la formule :
Masse molaire de Ba(NO3)2 = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Point d’ébullition du nitrate de baryum
Le point d’ébullition du Ba(NO3)2 est de 83°C. C’est la température à laquelle Ba(NO3)2 passe de l’état liquide à l’état gazeux. Cependant, Ba(NO3)2 se décompose avant d’atteindre son point d’ébullition, il n’est donc pas possible de le faire bouillir sans le décomposer en d’autres substances.
Nitrate de baryum Point de fusion
Le point de fusion du Ba(NO3)2 est de 592°C. C’est la température à laquelle Ba(NO3)2 passe du solide au liquide. Ba(NO3)2 est un solide cristallin blanc à température et pression ambiantes, mais il fond lorsqu’il est chauffé au-dessus de son point de fusion.
Densité du nitrate de baryum g/ml
La densité de Ba(NO3)2 est de 3,23 g/ml. C’est la masse par unité de volume de Ba(NO3)2. Pour le calculer, il faut diviser la masse d’un échantillon de Ba(NO3)2 par son volume :
Densité de Ba(NO3)2 = Masse / Volume
Par exemple, si nous avons un échantillon de 10 g de Ba(NO3)2 et que son volume est de 3,1 ml, alors sa densité est :
Densité de Ba(NO3)2 = 10 / 3,1 = 3,23 g/ml
Nitrate De Baryum Poids moléculaire
Le poids moléculaire de Ba(NO3)2 est le même que sa masse molaire, qui est de 261,337 g/mol. C’est la masse d’une mole de molécules Ba(NO3)2. Parfois, le terme poids moléculaire est utilisé de manière interchangeable avec masse molaire, mais ils ne sont pas exactement les mêmes. Le poids moléculaire fait référence à la masse moyenne d’une molécule d’une substance, tandis que la masse molaire fait référence à la masse d’une mole d’une substance.
Structure du nitrate de baryum
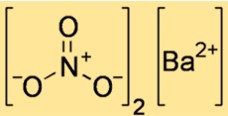
La structure de Ba(NO3)2 montre comment les atomes et les ions sont disposés dans l’espace. Ba(NO3)2 est un composé ionique, ce qui signifie qu’il est constitué d’ions baryum chargés positivement et d’ions nitrate chargés négativement, maintenus ensemble par des forces électrostatiques. La structure de Ba(NO3)2 peut être représentée par une cellule unitaire, qui est la plus petite unité répétitive qui montre la disposition des ions dans un réseau cristallin.
Une cellule unitaire de Ba(NO3)2 a une forme cubique, avec un ion baryum à chaque coin et un ion nitrate au centre de chaque face. Le numéro de coordination de chaque ion est six, ce qui signifie que chaque ion est entouré de six ions de charges opposées. La longueur de chaque bord de la cellule unitaire est de 0,65 nm.
Solubilité du nitrate de baryum
La solubilité de Ba(NO3)2 est la quantité de Ba(NO3)2 qui peut se dissoudre dans une quantité donnée de solvant, généralement de l’eau. La solubilité dépend de plusieurs facteurs, tels que la température, la pression et la présence d’autres substances dans la solution.
À 20°C et à pression atmosphérique, la solubilité du Ba(NO3)2 dans l’eau est d’environ 34 g pour 100 ml. Cela signifie que 34 g de Ba(NO3)2 peuvent se dissoudre dans 100 ml d’eau dans ces conditions. La solubilité augmente avec l’augmentation de la température et diminue avec l’augmentation de la pression.
Ba(NO3)2 est également soluble dans d’autres solvants, tels que l’éthanol, l’acétone et le méthanol, mais moins soluble que dans l’eau.
| Apparence | Solide blanc |
| Densité spécifique | 3.23 |
| Couleur | Incolore, argenté ou gris |
| Odeur | Inodore |
| Masse molaire | 261,337 g/mole |
| Densité | 3,23 g/ml |
| Point de fusion | 592°C |
| Point d’ébullition | 83°C |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | 34 g pour 100 ml à 20°C |
| Solubilité | Soluble dans l’éthanol, l’acétone et le méthanol ; insoluble dans l’éther et le chloroforme |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Pas disponible |
Sécurité et dangers du nitrate de baryum
Ba(NO3)2 est une substance toxique et oxydante. Cela peut vous nuire si vous l’avalez ou si vous le respirez. Cela peut irriter les yeux, la peau et le système respiratoire. Ba(NO3)2 peut également provoquer des spasmes musculaires, des problèmes cardiaques et la mort. Vous devez éviter tout contact avec Ba(NO3)2 et porter un équipement de protection lors de sa manipulation. Vous devez également le garder à l’écart de la chaleur, des étincelles, des flammes et des matériaux combustibles. Si vous êtes exposé au Ba(NO3)2, vous devez vous rincer les yeux et la peau avec de l’eau et consulter un médecin. Vous pouvez également prendre des sels de sulfate pour réduire la toxicité du baryum.
| Symboles de danger | O (oxydant), Xn (nocif) |
| Description de la sécurité | S13 : Conserver à l’écart des aliments et boissons y compris ceux pour animaux. S17 : Tenir à l’écart des matériaux combustibles. S22 : Ne respirez pas la poussière. S26 : En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. S36/37/39 : Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | UN1446 |
| Code SH | 2834 29 10 |
| Classe de danger | 5.1 (Matières comburantes) |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) = 355 mg/kg ; CL50 (inhalation, rat) = 0,15 mg/L/4h |
Méthodes de synthèse du nitrate de baryum
Différentes méthodes peuvent être utilisées pour créer Ba(NO3)2, qui est une substance solide blanche.
Une méthode consiste à faire réagir le carbonate de baryum avec de l’acide nitrique . Cela produit du Ba(NO3)2 et du dioxyde de carbone. Filtrez la solution Ba(NO3)2 pour éliminer les éventuelles impuretés de fer, puis évaporez-la pour obtenir des cristaux solides.
Une autre méthode consiste à faire réagir le sulfure de baryum avec de l’acide nitrique . Cela produit du Ba(NO3)2 et du sulfure d’hydrogène. Pour purifier et cristalliser la solution Ba(NO3)2, nous suivons le même processus que précédemment.
Une troisième méthode consiste à dissoudre le baryum métallique ou l’oxyde de baryum dans l’acide nitrique . Cela produit du Ba(NO3)2 et de l’hydrogène ou de l’eau. La solution contenant Ba(NO3)2 est ensuite concentrée et subit une cristallisation.
Une quatrième méthode consiste à utiliser la synthèse de sels fondus. Cela implique de chauffer un mélange de Ba(NO3)2 et d’un vésicant inorganique, tel que le chlorure d’ammonium, le bicarbonate de sodium ou le nitrite de sodium. Le vésicant se décompose et crée des pores dans les cristaux de Ba(NO3)2. Cela les rend plus fiables en tant qu’oxydants pyrotechniques.
Voici quelques-unes des méthodes permettant de synthétiser Ba(NO3)2. Ils utilisent tous l’acide nitrique comme réactif commun et produisent du Ba(NO3)2 comme produit.
Utilisations du nitrate de baryum
Certaines des utilisations de Ba(NO3)2 sont :
- Composés d’oxyde de baryum – Utilisés dans la production de matériaux contenant de l’oxyde de baryum, tels que la céramique, le verre et les tubes cathodiques.
- Flamme verte – Utilisée dans les feux de signalisation verts et les feux d’artifice, car elle brûle avec une flamme verte en raison de l’émission d’ions baryum.
- Rodenticide – Utilisé comme rodenticide pour tuer les rats et les souris, car il est toxique pour eux.
- Oxydant – Utilisé dans les détonateurs et les explosifs, c’est un oxydant puissant qui peut améliorer la combustion d’autres substances.
- Amorce – Utilisée dans les amorces et les balles traçantes, car elle assure l’allumage et la visibilité des munitions.
- Pigment – Utilisé dans la fabrication de peintures et de pigments, car il peut leur conférer une couleur blanche ou verte.
- Agent oxydant – Utilisé comme agent oxydant dans diverses réactions chimiques, telles que la synthèse du peroxyde de baryum et de l’hydroxyde de baryum.
- Explosifs – Utilisés dans la fabrication d’explosifs tels que le Baratol, qui est un mélange de Ba(NO3)2, de TNT et de liant.
Des questions:
Q : Le nitrate de baryum est-il soluble ?
R : Ba(NO3)2 est soluble dans l’eau et dans certains autres solvants, tels que l’éthanol, l’acétone et le méthanol.
Q : Le nitrate de baryum est-il utile pour le béton ?
R : Ba(NO3)2 n’est pas utile pour le béton, car il peut provoquer la corrosion des armatures en acier et la fissuration du béton.
Q : Un précipité se formera-t-il si des solutions de sulfate de potassium et de nitrate de baryum sont combinées ?
R : Oui, un précipité de sulfate de baryum (BaSO4) se formera si des solutions de sulfate de potassium (K2SO4) et de nitrate de baryum (Ba(NO3)2) sont combinées.
Q : Le nitrate de baryum a la formule Ba(NO3)2. Quelle affirmation est vraie à propos du nitrate de baryum ?
R : Une affirmation possible est la suivante : Ba(NO3)2 est un composé ionique composé d’un ion baryum et de deux ions nitrate.
Q : Le nitrate de baryum est-il volatil ?
R : Non, Ba(NO3)2 n’est pas volatil, car il a un point de fusion élevé et se décompose avant d’être bouilli.
Q : Le nitrate de baryum est-il neutre ?
R : Non, Ba(NO3)2 n’est pas neutre, car c’est un sel acide qui peut abaisser le pH d’une solution.
Q : Qu’est-ce qui est produit lors de la réaction de remplacement de Ba(NO3)2 et Na2SO4 ?
R : NaNO3 et BaSO4 sont produits lors de la réaction de remplacement de Ba(NO3)2 et Na2SO4.
Q : Le Ba(NO3)2 est-il soluble dans l’eau ?
R : Oui, Ba(NO3)2 est soluble dans l’eau, car il se dissout pour former des ions baryum et des ions nitrate.
Q : Quelle est l’équation ionique nette de la réaction du MgSO4 avec Ba(NO3)2 ?
R : L’équation ionique nette de la réaction du MgSO4 avec Ba(NO3)2 est :
Ba2+ + SO42- → BaSO4
Q : Quel est le nombre de moles dans 432 g de Ba(NO3)2 ?
R : Le nombre de moles dans 432 g de Ba(NO3)2 est :
n = m / M, n = 432 / 261,337, n = 1,653 moles
Q : Le Ba(NO3)2 est-il soluble ?
R : Oui, Ba(NO3)2 est soluble, car il se dissout pour former des ions baryum et des ions nitrate.
