Le nitrate d’ammonium (NH4NO3) est un composé chimique. Il peut être utilisé comme engrais ou comme explosif. Il est hautement soluble dans l’eau et hygroscopique.
| Nom de l’UICPA | Nitrate d’ammonium |
| Formule moléculaire | NH4NO3 |
| Numero CAS | 6484-52-2 |
| Synonymes | Sel d’ammonium de l’acide nitrique, Nitrate d’ammonium (AN), Nitratum d’ammonium, Nitrame, Nitramon |
| InChI | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Propriétés du nitrate d’ammonium
Formule de nitrate d’ammonium
Le nitrate d’ammonium est un composé chimique de formule NH4NO3. Il est constitué de deux ions : l’ammonium (NH4+) et le nitrate (NO3-), qui sont maintenus ensemble par une liaison ionique 2 . C’est une poudre cristalline blanche facilement soluble dans l’eau.
Nitrate D’Ammonium Masse molaire
La masse molaire de NH4NO3 est de 80,043 g/mol. Il peut être calculé en additionnant les masses molaires de ses éléments constitutifs : l’azote, l’hydrogène et l’oxygène. La masse molaire de l’azote est de 14,0067 g/mol, la masse molaire de l’hydrogène est de 1,00784 g/mol et la masse molaire de l’oxygène est de 15,9999 g/mol.
La masse molaire de NH4NO3 = 2 x masse molaire d’azote + 4 x masse molaire d’hydrogène + 3 x masse molaire d’oxygène
La masse molaire de NH4NO3 = 28,0134 g/mol + 4,03136 g/mol + 47,9997 g/mol
La masse molaire de NH4NO3 = 80,043 g/mol
Point d’ébullition du nitrate d’ammonium
Le NH4NO3 n’a pas de point d’ébullition défini. Il se décompose à haute température, libérant des gaz tels que l’azote, l’oxygène et la vapeur d’eau. La température de décomposition du NH4NO3 varie en fonction de la pureté, de l’humidité et de la présence d’impuretés ou d’additifs. La température de décomposition du NH4NO3 pur est d’environ 210 °C ou 483 K.
Point de fusion du nitrate d’ammonium
Le point de fusion du NH4NO3 est de 169,6 °C ou 442,8 K. Il subit une transition de phase d’une structure cristalline rhomboédrique à une structure cristalline cubique à cette température. Il peut également former un mélange eutectique avec l’eau, qui a un point de fusion inférieur d’environ -16 °C ou 257 K.
Densité du nitrate d’ammonium g/ml
La densité du NH4NO3 est de 1,725 g/ml ou 1725 kg/m3 à température et pression ambiantes. Elle est plus dense que l’eau, qui a une densité d’environ 1 g/ml ou 1 000 kg/m3 dans les mêmes conditions. La densité du NH4NO3 diminue à mesure que la température augmente, en raison de la dilatation thermique.
Ammonium Nitrate Poids moléculaire
Le poids moléculaire du NH4NO3 est le même que sa masse molaire, qui est de 80,043 g/mol. Le poids moléculaire est la masse d’une mole ou 6,022 x 10^(23) molécules de NH4NO3. Le poids moléculaire peut également être exprimé en unités de masse atomique (amu), définies comme un douzième de la masse d’un atome de carbone 12.
Le poids moléculaire de NH4NO3 en amu est de 80,043 x (1/12) x (10^(23)) amu
Le poids moléculaire de NH4NO3 en amu est d’environ 6,669 x 10^(23) amu
Structure du nitrate d’ammonium
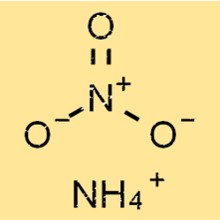
NH4NO3 a une structure ionique simple, composée d’ions ammonium chargés positivement et d’ions nitrate chargés négativement. L’ion ammonium a une forme tétraédrique, avec quatre atomes d’hydrogène liés à un atome d’azote central par des liaisons covalentes.
NH4+
H
|
HNH
|
H
L’ion nitrate a une forme planaire trigonale, avec trois atomes d’oxygène liés à un atome d’azote central par des liaisons covalentes, dont l’une est une double liaison.
N ° 3-
Ô
||
Ô
Solubilité du nitrate d’ammonium
La solubilité du NH4NO3 fait référence à la quantité de ce composé qui se dissout dans l’eau ou d’autres solvants. Le NH4NO3 est très soluble dans l’eau et sa solubilité augmente avec la température. Par exemple, à 20 °C, 150 g de NH4NO3 peuvent se dissoudre dans 100 ml d’eau, mais à 100 °C, 1 024 g peuvent se dissoudre dans la même quantité d’eau. NH4NO3 se dissout également dans le méthanol, l’éthanol et l’acétone, mais pas dans l’éther diéthylique ou le chloroforme. La solubilité du NH4NO3 dépend de la présence d’autres substances, telles que des acides, des bases, des sels ou des composés organiques. Certaines de ces substances peuvent affecter la stabilité du NH4NO3 et provoquer sa décomposition ou son explosion.
| Apparence | Solide cristallin blanc |
| Densité spécifique | 1,725 |
| Couleur | Blanc ou gris |
| Odeur | Inodore |
| Masse molaire | 80,043 g/mole |
| Densité | 1,725 g/ml ou 1725 kg/m3 |
| Point de fusion | 169,6 °C ou 442,8 K |
| Point d’ébullition | Environ. 210 °C ou 483 K (se décompose) |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | Endothermique, 118 g/100 ml (0 °C), 150 g/100 ml (20 °C), 297 g/100 ml (40 °C), 410 g/100 ml (60 °C), 576 g/100 ml (80 °C), 1024 g/100 ml (100 °C) |
| Solubilité | Soluble dans l’eau, le méthanol, l’éthanol, l’acétone ; insoluble dans l’éther diéthylique, le chloroforme |
| Pression de vapeur | Négligeable à température ambiante |
| Densité de vapeur | Sans objet (solide) |
| pKa | 9,25 (pour NH4+) |
| pH | 5,0-6,0 (solution aqueuse à 10 %) |
Sécurité et dangers du nitrate d’ammonium
La sécurité et les dangers du NH4NO3 sont importants à connaître pour toute personne manipulant ou stockant ce composé chimique. Le NH4NO3 est un comburant qui peut intensifier un incendie et provoquer des explosions s’il est mélangé à des matériaux combustibles ou exposé à la chaleur, à un choc ou à une contamination. Le NH4NO3 peut également libérer des gaz toxiques tels que des oxydes d’azote et de l’ammoniac lorsqu’il est décomposé. Par conséquent, les gens doivent suivre ces précautions de sécurité lorsqu’ils manipulent du NH4NO3 :
- Conservez-le dans un endroit frais, sec et bien ventilé, à l’écart des sources d’incendie, des substances organiques, des acides, des métaux et autres matériaux incompatibles.
- Portez des vêtements de protection, des gants, une protection pour les yeux et le visage lors de sa manipulation.
- Évitez de créer de la poussière et utilisez une ventilation adéquate lors du transfert.
- Se laver soigneusement les mains et le visage après l’avoir manipulé.
- Ne pas l’ingérer ni l’inhaler et consulter un médecin en cas d’exposition.
- Informez les intervenants d’urgence locaux de la présence de NH4NO3 dans l’installation et préparez un plan d’intervention d’urgence.
| Symboles de danger | O (agent oxydant), Xi (irritant) |
| Description de la sécurité | S17 (conserver à l’écart des matières combustibles), S26 (en cas de contact avec les yeux, rincer immédiatement abondamment à l’eau et consulter un médecin), S36/37/39 (porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage), S42 (pendant la fumigation/pulvérisation, porter un équipement respiratoire approprié) |
| Numéros d’identification de l’ONU | S17 (conserver à l’écart des matières combustibles), S26 (en cas de contact avec les yeux, rincer immédiatement abondamment à l’eau et consulter un médecin), S36/37/39 (porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage), S42 (pendant la fumigation/pulvérisation, porter un équipement respiratoire approprié) |
| Code SH | 3102.30 (nitrate d’ammonium, même en solution aqueuse) |
| Classe de danger | 5.1 (agent oxydant) |
| Groupe d’emballage | III (faible danger) |
| Toxicité | DL50 (orale, rat) = 2 085-5 300 mg/kg |
Méthodes de synthèse du nitrate d’ammonium
Pour produire ce composé chimique, largement utilisé comme engrais et explosif, les chimistes utilisent diverses méthodes de synthèse de NH4NO3. Il existe différentes méthodes pour synthétiser le NH4NO3, mais les plus courantes sont :
- Le procédé Haber-Bosch et Ostwald : cette méthode consiste à faire réagir des gaz d’azote et d’hydrogène pour former de l’ammoniac, puis à oxyder l’ammoniac avec de l’air pour former de l’acide nitrique . Pour former NH4NO3, ils neutralisent l’ammoniac et l’acide nitrique. Cette méthode nécessite une température, une pression et une énergie élevées et émet beaucoup de dioxyde de carbone.
- La réaction de métathèse : Cette méthode consiste à faire réagir un sel d’ammonium soluble avec un sel de nitrate soluble pour former NH4NO3 et un autre sel. Par exemple, le sulfate d’ammonium et le nitrate de baryum peuvent réagir pour former du NH4NO3 et du sulfate de baryum. Cette méthode est simple et ne nécessite pas de température ou de pression élevée, mais elle produit un sous-produit qui devra peut-être être séparé ou éliminé.
- Le procédé plasma : Cette méthode consiste à utiliser un plasma à basse température et basse pression pour fixer l’azote de l’air dans le sol, formant ainsi du NH4NO3 directement dans le sol. Cette méthode ne nécessite pas d’hydrogène gazeux ni de catalyseurs et n’émet pas de dioxyde de carbone. Il peut également enrichir le sol en azote et améliorer la croissance des plantes.
Utilisations du nitrate d’ammonium
Voici quelques utilisations du NH4NO3 :
- Engrais : NH4NO3 est une source courante d’azote pour les plantes, car il contient environ 33,5 % d’azote, la totalité étant disponible pour l’absorption par les plantes. Les fabricants enduisent des pastilles blanches ou grises de carbonate d’ammonium avec de l’argile pour les empêcher de s’agglutiner et d’absorber l’humidité. Ils peuvent l’appliquer sous forme solide ou en solution car l’eau le dissout facilement.
- Explosif : NH4NO3 est un agent oxydant qui peut améliorer la détonation d’autres explosifs, tels que la nitroglycérine, le TNT, le RDX ou la poudre d’aluminium. Un explosif industriel largement utilisé, qui représente 80 % des explosifs utilisés en Amérique du Nord, contient de l’ANFO (NH4NO3 et mazout) comme ingrédient principal. Il faut un initiateur puissant pour le faire exploser lorsqu’il est utilisé dans des engins explosifs improvisés, mais les applications industrielles peuvent également l’utiliser.
- Pyrotechnie : les feux d’artifice peuvent utiliser du NH4NO3 pour créer divers effets, tels que de la fumée, des étincelles, des étoiles et des éclairs. Les compresses froides peuvent également l’utiliser, ce qui produit une réaction endothermique lorsqu’elle est mélangée à de l’eau.
- Autres utilisations : Utilisé comme précurseur du protoxyde d’azote (gaz hilarant), d’un anesthésique et d’un propulseur. Les oxydes d’azote peuvent être utilisés comme absorbants, la levure et les antibiotiques peuvent être utilisés comme nutriments, et les mélanges de congélation peuvent être utilisés comme composants.
Des questions:
Q : D’où vient l’engrais au nitrate d’ammonium ?
R : L’engrais NH4NO3 est un produit synthétique issu de la réaction de l’ammoniac et de l’acide nitrique. L’ammoniac est obtenu à partir de gaz naturel ou d’autres sources, et l’acide nitrique est produit en oxydant l’ammoniac avec de l’air. L’engrais NH4NO3 peut également être produit en utilisant un procédé plasma qui fixe l’azote de l’air dans le sol.
Q : Qu’est-ce que le nitrate d’ammonium ?
R : NH4NO3 est un composé chimique de formule NH4NO3. C’est un sel cristallin blanc composé d’ions ammonium et nitrate. Il est hautement soluble dans l’eau et hygroscopique sous forme solide, bien qu’il ne forme pas d’hydrates.
Q : À quoi sert le nitrate d’ammonium ?
R : Le NH4NO3 est principalement utilisé à deux fins : comme engrais et comme explosif. En tant qu’engrais, il apporte aux plantes de l’azote, essentiel à leur croissance et à leur métabolisme. En tant qu’explosif, il agit comme un comburant qui favorise la détonation d’autres explosifs, comme l’ANFO (NH4NO3 et mazout) 1 . Il peut également être utilisé à d’autres fins, comme la fabrication de protoxyde d’azote (gaz hilarant), de compresses froides, de feux d’artifice et de nutriments pour levures.
Q : Quelle est la formule moléculaire du nitrate d’ammonium ?
R : La formule moléculaire du nitrate d’ammonium est NH4NO3. Il a une masse molaire de 80,043 g/mol et contient 35 % d’azote en masse.
Q : De quoi est composé l’engrais au nitrate d’ammonium ?
R : L’engrais NH4NO3 est composé de NH4NO3 et parfois d’autres additifs, tels que de l’argile, des agents antiagglomérants ou des stabilisants. La qualité commerciale contient environ 33,5 % d’azote, la totalité sous des formes disponibles pour l’absorption par les plantes.
Q : Le nitrate d’ammonium est-il un acide ou une base ?
R : NH4NO3 n’est ni un acide ni une base, mais un sel. Il peut se dissocier dans l’eau en ions ammonium et nitrate, qui peuvent agir comme des acides ou des bases faibles selon le pH de la solution. L’ion ammonium a un pKa de 9,25, ce qui signifie qu’il peut donner un proton et agir comme un acide dans les solutions basiques. L’ion nitrate n’a pas de pKa, ce qui signifie qu’il ne peut pas donner ou accepter de protons, mais il peut agir comme une base en formant de l’acide nitrique avec des ions hydronium dans des solutions acides.
Q : Explosion de nitrate d’ammonium ?
R : Une explosion de NH4NO3 est une réaction chimique violente qui se produit lorsque le NH4NO3 se décompose rapidement et libère de grandes quantités de gaz, tels que l’azote, l’oxygène et la vapeur d’eau. La décomposition peut être déclenchée par la chaleur, un choc, une friction, une contamination ou un confinement. Une explosion de NH4NO3 peut causer de graves dommages aux bâtiments, aux personnes et à l’environnement. Quelques exemples d’explosions de NH4NO3 sont la catastrophe de Texas City en 1947, l’explosion d’Oppau en 1921, l’explosion de Tianjin en 2015 et l’explosion de Beyrouth en 2020.
Q : Comment acheter du nitrate d’ammonium ?
R : L’achat de NH4NO3 peut nécessiter une licence ou un permis selon le pays ou la région où vous vivez. En effet, le NH4NO3 peut être utilisé pour fabriquer des explosifs ou des engins explosifs improvisés pouvant constituer une menace pour la sécurité publique. Vous devrez peut-être également fournir votre identité, votre adresse, vos coordonnées et l’utilisation prévue du produit lors de l’achat de NH4NO3. On peut acheter du NH4NO3 auprès de fournisseurs ou de distributeurs agréés qui respectent les réglementations et normes locales. Vous devez également suivre les directives appropriées de stockage et de manipulation pour éviter les accidents ou la mauvaise utilisation du NH4NO3.
