Le chlorure de sodium (NaCl) est un composé composé d’ions sodium et chlore. Il est communément appelé sel de table et est utilisé pour assaisonner les aliments et conserver les produits alimentaires.
| Nom UICPA | Chlorure de sodium |
| Formule moléculaire | NaCl |
| Numero CAS | 7647-14-5 |
| Synonymes | Halite, sel gemme, solution saline, sel marin |
| InChI | InChI=1S/ClH.Na/h1H;/q;+1/p-1 |
Formule de chlorure de sodium
La formule chimique du chlorure de sodium est NaCl, représentant la combinaison d’un ion sodium (Na+) et d’un ion chlorure (Cl-). La formule indique le nombre relatif d’atomes ou d’ions dans le composé, permettant une identification et une représentation faciles de sa composition.
Masse molaire de NaCl
La masse molaire du chlorure de sodium, également appelé sel de table, est de 58,44 g/mol. Cela signifie qu’une mole de chlorure de sodium contient 58,44 grammes du composé. La masse molaire est calculée en ajoutant les masses atomiques de sodium (Na) et de chlore (Cl) dans le composé, qui sont respectivement de 22,99 g/mol et 35,45 g/mol.
Point d’ébullition du chlorure de sodium
Le chlorure de sodium a un point d’ébullition élevé de 1 413 °C (2 575 °F) en raison de sa liaison ionique. Lorsqu’il est chauffé, l’apport d’énergie rompt les liaisons ioniques entre les ions sodium et chlorure, provoquant un changement de phase du composé d’un état solide à un état liquide. Le point d’ébullition du chlorure de sodium est plus élevé que celui de nombreux autres composés en raison de la forte attraction électrostatique entre les ions.
Point de fusion du chlorure de sodium
Le point de fusion du chlorure de sodium est de 801°C (1474°F). Tout comme le point d’ébullition, le point de fusion élevé est dû aux fortes liaisons ioniques entre les ions sodium et chlorure. Lorsqu’il est chauffé, l’apport d’énergie surmonte les forces électrostatiques qui maintiennent les ions ensemble, provoquant la transition du composé d’un état solide à un état liquide.
Densité du chlorure de sodium g/ml
La densité du chlorure de sodium est de 2,165 g/mL à température ambiante (25°C ou 77°F). La densité est une mesure de la masse par unité de volume d’une substance. La densité élevée du chlorure de sodium est due à la disposition compacte de ses atomes et à la forte liaison ionique entre les ions sodium et chlorure.
Poids moléculaire du chlorure de sodium
Le poids moléculaire du chlorure de sodium est de 58,44 g/mol, comme mentionné précédemment. Le poids moléculaire est calculé en additionnant les poids atomiques de tous les atomes d’une molécule. Bien que le chlorure de sodium n’existe pas en tant que molécule au sens traditionnel du terme, son poids moléculaire est calculé sur la base de l’unité de formule NaCl.
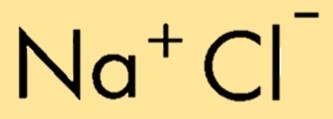
Structure du chlorure de sodium
Le chlorure de sodium a une structure cristalline constituée d’un arrangement régulier d’ions sodium et chlorure dans un rapport 1:1. La structure est un réseau cubique à faces centrées, avec chaque ion sodium entouré de six ions chlorure et chaque ion chlorure entouré de six ions sodium. La liaison ionique dans le chlorure de sodium donne lieu à une structure de réseau très stable et difficile à briser.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2.165 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 58,44 g/mole |
| Densité | 2,165 g/ml |
| Point de fusion | 801°C (1474°F) |
| Point d’ébullition | 1 413 °C (2 575 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 359 g/L à 20°C |
| Solubilité | Soluble dans l’eau et le glycérol ; insoluble dans l’éthanol et l’acétone |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | 7 |
| pH | 7 (neutre) |
Sécurité et dangers du chlorure de sodium
Le chlorure de sodium (NaCl) est généralement considéré comme sans danger pour la consommation et l’utilisation humaines. Cependant, l’exposition à des concentrations élevées de NaCl peut entraîner une irritation des yeux, de la peau et des voies respiratoires. L’ingestion de grandes quantités de NaCl peut entraîner une déshydratation, des déséquilibres électrolytiques et même la mort. Le chlorure de sodium peut également présenter un risque d’incendie et d’explosion lorsqu’il est en contact avec des matériaux combustibles. Une manipulation et un stockage appropriés sont nécessaires pour éviter les accidents. Il est important de suivre les directives et précautions de sécurité appropriées lors de la manipulation et de l’utilisation du NaCl afin de minimiser les risques de dommages.
| Symboles de danger | Aucun |
| Description de la sécurité | Nocif en cas d’ingestion ou d’inhalation. Provoque une irritation de la peau et des yeux. |
| Numéros d’identification de l’ONU | ONU 7646 |
| Code SH | 2501.00.90 |
| Classe de danger | Non toxique |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | DL50 (orale, rat) – 3 000 mg/kg |
Méthodes de synthèse du chlorure de sodium
Diverses sources peuvent fournir du chlorure de sodium, notamment les mines de sel et l’eau de mer, mais il est également possible de le synthétiser en laboratoire par des réactions chimiques.
Une méthode courante de synthèse du chlorure de sodium consiste à faire réagir l’acide chlorhydrique (HCl) et l’hydroxyde de sodium (NaOH) . Cette réaction produit du chlorure de sodium et de l’eau comme sous-produits. L’équation de cette réaction est :
HCl + NaOH → NaCl + H2O
Une autre méthode consiste à faire réagir du carbonate de sodium (Na2CO3) avec de l’acide chlorhydrique (HCl) pour produire du chlorure de sodium, du dioxyde de carbone et de l’eau. L’équation de cette réaction est :
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
La réaction entre le sodium et le chlore gazeux est l’une de ces méthodes de synthèse du chlorure de sodium. Cette réaction nécessite des températures élevées et un contrôle minutieux pour éviter la formation de sous-produits indésirables. L’équation de cette réaction est :
2Na + Cl2 → 2NaCl
Les chimistes peuvent choisir de modifier ou de varier les méthodes de synthèse du chlorure de sodium en fonction de facteurs tels que le coût, la disponibilité des réactifs, ainsi que la pureté et le rendement souhaités du produit final. Ces méthodes assurent la production de chlorure de sodium même si les sources naturelles sont rares.
Utilisations du chlorure de sodium
Le chlorure de sodium, également connu sous le nom de sel de table, a de nombreuses utilisations dans diverses industries et applications. Certaines des utilisations courantes du chlorure de sodium sont :
- Industrie alimentaire : utilisé comme assaisonnement et exhausteur de goût dans divers produits alimentaires, notamment les collations, les viandes transformées et les produits de boulangerie.
- Industrie médicale : Utilisé dans les solutions intraveineuses et autres traitements médicaux pour reconstituer les liquides et les électrolytes du corps.
- Industrie chimique : utilisée dans la production de divers produits chimiques, notamment le chlore, l’hydroxyde de sodium et le carbonate de sodium.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour éliminer les impuretés et la rendre propre à la consommation.
- Agriculture : Utilisé comme engrais pour les cultures, en particulier dans les zones où le sol est déficient en nutriments essentiels.
- Dégivrage : Utilisé comme agent de dégivrage sur les routes et les trottoirs en hiver pour prévenir les accidents dus aux surfaces glissantes.
- Industrie textile : Utilisée dans la production de fibres synthétiques, telles que le nylon et le polyester.
- Industrie pétrolière et gazière : utilisée dans le forage et l’extraction de pétrole et de gaz.
- Élevage : utilisé comme complément alimentaire pour le bétail afin de favoriser une croissance et un développement sains.
Ce ne sont là que quelques exemples des nombreuses utilisations du chlorure de sodium. Sa polyvalence et sa disponibilité en font un ingrédient essentiel dans de nombreux produits et processus dans un large éventail d’industries.
Des questions:
Q : Le chlorure de sodium est-il un composé ?
R : Oui, le chlorure de sodium est un composé.
Q : Le chlorure de sodium est-il ionique ou covalent ?
R : Le chlorure de sodium est un composé ionique.
Q : Qu’est-ce que le chlorure de sodium ?
R : Le chlorure de sodium est un composé cristallin blanc de formule chimique NaCl. Il est communément appelé sel de table et est essentiel à l’alimentation humaine et animale.
Q : À quoi sert le chlorure de sodium ?
R : Le chlorure de sodium a de nombreuses utilisations dans diverses industries et applications, notamment comme assaisonnement et exhausteur de goût dans les aliments, comme traitement médical, dans la production de produits chimiques, dans le traitement de l’eau, comme agent de dégivrage, dans le textile et le pétrole. et du gaz, et comme complément alimentaire pour le bétail.
Q : Le chlorure de sodium est-il soluble dans l’eau ?
R : Oui, le chlorure de sodium est hautement soluble dans l’eau.
