L’hydrazine ou N2H4 est un composé incolore et hautement réactif composé d’azote et d’hydrogène. Il est utilisé comme propulseur de fusée, dans les produits pharmaceutiques et chimiques agricoles, et comme agent réducteur dans les réactions chimiques.
| Nom UICPA | Hydrazine |
| Formule moléculaire | N2H4 |
| Numero CAS | 302-01-2 |
| Synonymes | Diamine; Diazane; Hydrure d’azote ; Hydrazine anhydre ; Hydrazine anhydre ; Hydroxyde d’hydrazinium; Hydrazine hydratée ; Méthylhydrazine; Hydrazine symétrique |
| InChI | InChI=1S/H4N2/c1-2/h2H,1H2 |
Structure de Lewis N2H4 :
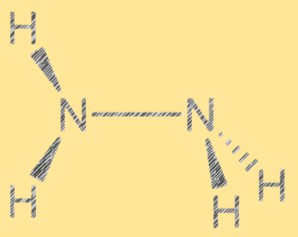
La structure de Lewis de l’hydrazine montre la disposition des électrons dans la molécule. La structure se compose de deux atomes d’azote, chacun avec une paire d’électrons libres, et de quatre atomes d’hydrogène. Les deux atomes d’azote sont reliés par une seule liaison covalente et chaque atome d’azote est également lié à deux atomes d’hydrogène. La structure de Lewis de l’hydrazine contribue à expliquer sa réactivité et ses propriétés.
Nom du composé N2H4 :
Le nom du composé N2H4 est hydrazine. Le nom vient du fait que l’hydrazine est un composé contenant des atomes d’hydrogène et d’azote. L’hydrazine est également connue sous divers autres noms, notamment diamine, diazane et hydrure d’azote.
Masse molaire N2H4 :
La masse molaire de l’hydrazine, de formule moléculaire N2H4, est de 32,04 g/mol. C’est un composé relativement léger composé de deux atomes d’azote et de quatre atomes d’hydrogène. La faible masse molaire de l’hydrazine est l’une des raisons pour lesquelles elle est couramment utilisée comme carburant pour fusée, car elle offre un rapport poussée/poids élevé.
Point d’ébullition de l’hydrazine :
L’hydrazine a un point d’ébullition de 113,5 °C (236,3 °F) à pression atmosphérique. Ce faible point d’ébullition signifie que l’hydrazine peut facilement se vaporiser, ce qui peut la rendre dangereuse à manipuler. Lorsqu’elle est chauffée, l’hydrazine peut se décomposer en azote gazeux et en hydrogène gazeux, ce qui peut également la rendre dangereuse.
Point de fusion de l’hydrazine :
Le point de fusion de l’hydrazine est de -51,7 °C (-61,06 °F). Cela signifie que l’hydrazine est un liquide à température et pression ambiantes. Son point de fusion bas signifie également qu’il peut facilement se solidifier à des températures plus froides, ce qui peut le rendre difficile à manipuler.
Densité de l’hydrazine g/ml :
La densité de l’hydrazine est de 1,00 g/mL à température et pression ambiantes. Cela signifie que l’hydrazine est légèrement plus dense que l’eau, qui a une densité de 1,00 g/mL dans les mêmes conditions.
Poids moléculaire de l’hydrazine :
Le poids moléculaire de l’hydrazine est de 32,04 g/mol. Cette valeur est utilisée pour calculer la quantité d’hydrazine nécessaire dans les réactions chimiques et dans d’autres applications.
Structure de l’hydrazine :
La structure de l’hydrazine est constituée de deux atomes d’azote liés entre eux par une seule liaison covalente, chaque atome d’azote étant également lié à deux atomes d’hydrogène. Cela donne à l’hydrazine une structure moléculaire symétrique en forme de V. La structure de l’hydrazine joue un rôle important dans sa réactivité et ses propriétés.
Formule d’hydrazine :
La formule chimique de l’hydrazine est N2H4. Cette formule indique que l’hydrazine est constituée de deux atomes d’azote et de quatre atomes d’hydrogène. La formule est utilisée pour représenter l’hydrazine dans des équations et des réactions chimiques.
| Apparence | Liquide incolore à jaune pâle |
| Gravité spécifique | 1,00 g/ml |
| Couleur | Incolore |
| Odeur | Odeur d’ammoniaque |
| Masse molaire | 32,04 g/mole |
| Densité | 1,00 g/ml |
| Point de fusion | -51,7 °C (-61,06 °F) |
| Point d’ébullition | 113,5 °C (236,3 °F) |
| Point d’éclair | 38 °C (100 °F) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans l’éthanol, l’éther diéthylique, le chloroforme |
| Pression de vapeur | 72 mmHg à 20 °C |
| Densité de vapeur | 1,0 (air=1) |
| pKa | 8 |
| pH | Basique (pH > 7) |
Sécurité et dangers de l’hydrazine
L’hydrazine est un composé hautement réactif et dangereux qui nécessite une manipulation et un stockage prudents. Il est toxique et peut provoquer de graves brûlures au contact de la peau, des yeux ou des muqueuses. L’inhalation de vapeurs d’hydrazine peut également provoquer une irritation respiratoire, des lésions pulmonaires et, dans les cas extrêmes, être mortelle. L’hydrazine est également inflammable et peut s’enflammer facilement, notamment au contact de certaines matières telles que les agents oxydants. En raison de ces dangers, des précautions de sécurité appropriées et un équipement de protection individuelle doivent être utilisés lors de la manipulation de l’hydrazine, et celui-ci ne doit être utilisé que dans des zones bien ventilées par des professionnels qualifiés ayant reçu une formation de sécurité appropriée.
| Symboles de danger | Crâne et os croisés, flamme |
| Description de la sécurité | Utiliser uniquement dans des zones bien ventilées. Portez des gants, des vêtements et une protection des yeux/du visage. Évitez tout contact avec la peau, les yeux et les vêtements. Tenir à l’écart de la chaleur, des étincelles et des flammes. |
| Numéros d’identification de l’ONU | ONU 2030 |
| Code SH | 282510 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II |
| Toxicité | Très toxique par ingestion, inhalation et contact cutané. Peut provoquer de graves brûlures et des lésions tissulaires. Une exposition à long terme peut provoquer des lésions hépatiques et rénales et peut être potentiellement cancérigène. |
Méthodes de synthèse de l’hydrazine
L’hydrazine peut être synthétisée par diverses méthodes, en fonction de la pureté souhaitée et de l’application spécifique. Certaines méthodes courantes de synthèse de l’hydrazine sont les suivantes :
- Procédé Raschig : Cette méthode implique la réaction de l’ammoniac et de l’hypochlorite de sodium en présence d’un catalyseur tel que le cuivre ou le nickel.
- Procédé Olin-Raschig : Ce procédé implique la réaction de l’urée et de l’acide chlorhydrique pour produire de l’hydrate d’hydrazine.
- Procédé kétazine : Ce procédé implique la réaction de l’acétone avec l’ammoniac en présence d’un catalyseur tel que le nickel de Raney.
- Procédé au peroxyde : Ce procédé implique la réaction du peroxyde d’hydrogène et de l’ammoniac en présence d’un catalyseur tel que le platine ou le palladium.
- Procédé Bayer : Ce procédé implique la réaction de l’hypochlorite de sodium avec de l’urée en présence d’un catalyseur tel que le cuivre ou le nickel.
- Réaction de Houben-Hoesch : Cette réaction implique la réaction de l’acide nitreux avec l’ammoniac en présence d’un agent réducteur tel que le zinc.
Chaque méthode a ses propres avantages et inconvénients, et le choix de la méthode dépendra de facteurs tels que le coût, le rendement, la pureté et les considérations de sécurité. La synthèse de l’hydrazine doit être effectuée avec prudence, car l’hydrazine est une substance dangereuse et peut présenter un risque pour la santé et la sécurité humaines si elle n’est pas manipulée correctement.
Utilisations de l’hydrazine
Le N2H4 a un large éventail d’applications industrielles, commerciales et militaires en raison de ses propriétés chimiques uniques. Certaines utilisations courantes du N2H4 comprennent :
- Les entreprises utilisent le N2H4 comme carburant pour fusées en raison de sa teneur élevée en énergie et de sa stabilité.
- Le N2H4 sert d’agent de polymérisation dans la production de certains polymères, notamment le nylon et le Kevlar.
- Les chimistes utilisent le N2H4 comme agent réducteur dans les réactions de synthèse chimique, en particulier dans la production de produits pharmaceutiques, de pesticides et d’autres composés organiques.
- Le N2H4 fonctionne comme agent réducteur dans les procédés de placage de métaux, en particulier pour le nickelage.
- Les usines de traitement de l’eau utilisent le N2H4 comme désoxygénant, en particulier dans les chaudières et les tours de refroidissement.
- Les photographes utilisent le N2H4 comme révélateur photographique, notamment en photographie noir et blanc.
- Les constructeurs automobiles comptent sur le N2H4 comme gonfleur dans les systèmes d’airbags automobiles.
- Les industries utilisent le N2H4 comme agent nettoyant pour certains équipements et surfaces, notamment dans l’industrie électronique.
Bien que l’hydrazine ait de nombreuses applications utiles, elle constitue également une substance dangereuse et doit être manipulée avec précaution. Des précautions de sécurité appropriées et un équipement de protection individuelle doivent être utilisés lors de la manipulation de l’hydrazine, et ils ne doivent être utilisés que par des professionnels qualifiés ayant reçu une formation de sécurité appropriée.
Des questions:
Quel est l’indice d’oxydation (état d’oxydation) du N dans N2H4 ?
Dans N2H4, l’indice d’oxydation (état d’oxydation) de N est -2. Chaque atome d’hydrogène a un nombre d’oxydation de +1, et comme N2H4 est une molécule neutre, la somme des nombres d’oxydation de tous les atomes doit être égale à zéro. Puisqu’il y a deux atomes d’azote dans N2H4, le nombre total d’oxydation de l’azote dans la molécule est de -4. Par conséquent, le nombre d’oxydation de chaque atome d’azote est de -2, ce qui équilibre les nombres d’oxydation des atomes d’hydrogène.
Quel est le nom du composé N2H4 ?
Le composé N2H4 est communément appelé hydrazine.
Quels sont les rapports molaires de l’hydrazine (n2h4) au peroxyde d’hydrogène (h2o2) et de l’hydrazine à l’eau ?
Les rapports molaires de l’hydrazine (N2H4) au peroxyde d’hydrogène (H2O2) et de l’hydrazine à l’eau peuvent être déterminés à partir des équations chimiques équilibrées des réactions respectives.
Lorsque l’hydrazine réagit avec le peroxyde d’hydrogène, elle produit de l’azote gazeux (N2), de l’eau (H2O) et de l’oxygène gazeux (O2) selon l’équation équilibrée suivante :
N2H4 + H2O2 → N2 + 2H2O + O2
D’après cette équation, le rapport molaire de l’hydrazine au peroxyde d’hydrogène est de 1:1. Cela signifie que pour chaque mole d’hydrazine utilisée dans la réaction, une mole de peroxyde d’hydrogène est consommée.
Lorsque l’hydrazine réagit avec l’eau, elle forme de l’hydrate d’hydrazine, qui répond à la formule chimique N2H4·H2O. L’équation chimique équilibrée de cette réaction est :
N2H4 + H2O → N2H4·H2O
D’après cette équation, le rapport molaire hydrazine/eau est de 1:1. Cela signifie que pour chaque mole d’hydrazine utilisée dans la réaction, une mole d’eau est consommée et une mole d’hydrate d’hydrazine est produite.
