Le n-pentane est un hydrocarbure de formule moléculaire C5H12. Il est utilisé comme solvant, combustible et agent gonflant pour l’isolation en mousse. Son point d’ébullition est de 36°C.
| Nom UICPA | Pentane |
| Formule moléculaire | C5H12 |
| Numero CAS | 109-66-0 |
| Synonymes | n-Amylhydrure, Skellysolve A, hydrure d’amyle, hydrure de pentyle, UN 1265 |
| InChI | InChI=1S/C5H12/c1-3-5-4-2/h3-5H2,1-2H3 |
Propriétés du n-pentane
Point d’ébullition du pentane
Le pentane a un point d’ébullition de 36,07°C (97,13°F) à pression standard (1 atm). C’est un liquide volatil et inflammable qui s’évapore facilement à température ambiante. Son faible point d’ébullition le rend utile comme agent gonflant pour les mousses isolantes et comme carburant pour les moteurs à combustion interne.
Formule pentane
La formule chimique du pentane est C5H12. C’est un alcane à chaîne droite et appartient au groupe des hydrocarbures. La formule indique le nombre et le type d’atomes présents dans une molécule de pentane. La formule du pentane est importante pour déterminer son comportement dans diverses applications, comme sa réactivité avec d’autres substances.
Masse molaire du pentane
La masse molaire du pentane, également appelé normal-pentane, est de 72,15 g/mol. C’est un alcane à chaîne droite et possède cinq atomes de carbone et 12 atomes d’hydrogène. Sa masse molaire est calculée en additionnant les poids atomiques du carbone et de l’hydrogène dans la molécule. La masse molaire du pentane est importante pour déterminer la quantité de composé nécessaire dans diverses réactions chimiques.
Point de fusion du pentane
Le pentane a un point de fusion de -129,8°C (-201,6°F). C’est un liquide incolore à température et pression ambiantes, mais il peut geler et se transformer en solide à basse température. Le point de fusion du pentane est important pour déterminer son comportement dans diverses applications, telles que la réfrigération et le transfert de chaleur.
Densité du pentane g/ml
La densité du pentane est de 0,63 g/mL à 20°C. C’est un liquide moins dense que l’eau et il flotte à la surface de l’eau. La densité du pentane est importante pour déterminer son comportement dans diverses applications, telles que le mélange avec d’autres liquides et son aptitude à servir de carburant.
Poids moléculaire du pentane
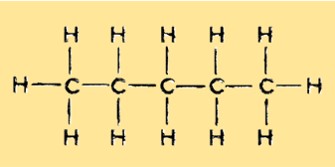
Le poids moléculaire du pentane est de 72,15 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule de pentane. Le poids moléculaire du pentane est important pour déterminer son comportement dans diverses applications, comme sa solubilité dans divers solvants.
Structure du pentane
Le pentane a une structure linéaire non ramifiée avec cinq atomes de carbone et 12 atomes d’hydrogène. C’est un hydrocarbure saturé et appartient au groupe des alcanes. Chaque atome de carbone est lié à deux atomes d’hydrogène, à l’exception des deux carbones terminaux qui sont liés à trois atomes d’hydrogène.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,626 – 0,63 à 20°C |
| Couleur | Incolore |
| Odeur | Odeur d’essence |
| Masse molaire | 72,15 g/mole |
| Densité | 0,63 g/mL à 20°C |
| Point de fusion | -129,8°C (-201,6°F) |
| Point d’ébullition | 36,07°C (97,13°F) |
| Point d’éclair | -49°C (-56,2°F) |
| Solubilité dans l’eau | 17,5 mg/L à 20°C |
| Solubilité | Insoluble dans l’eau, soluble dans les solvants organiques |
| Pression de vapeur | 380 mmHg à 25°C |
| Densité de vapeur | 2,5 (air=1) |
| pKa | ~45 |
| pH | N’est pas applicable |
Sécurité et dangers du n-pentane
Le n-pentane est un liquide inflammable et peut former des mélanges explosifs avec l’air. Il présente un risque d’incendie et d’explosion et doit être manipulé avec précaution. Il peut provoquer une irritation des yeux, de la peau et des voies respiratoires, et une exposition prolongée peut provoquer des étourdissements et des maux de tête. Il est important d’utiliser un équipement de protection individuelle approprié lors de la manipulation du n-Pentane. En cas d’incendie, utilisez des agents extincteurs appropriés, tels que du dioxyde de carbone ou de la poudre chimique sèche. Il est également important de conserver le n-Pentane dans un endroit frais et bien ventilé et à l’écart des sources d’ignition.
| Symboles de danger | F, Xi |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Utilisez uniquement des outils anti-étincelles. Gardez le récipient bien fermé. Ne respirez pas les vapeurs. Evitez le contact avec les yeux, la peau et les vêtements. Utiliser uniquement dans un endroit bien ventilé. En cas d’incendie, utiliser des agents extincteurs appropriés. |
| Numéros d’identification de l’ONU | UN1265 |
| Code SH | 2901.10.00 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | Peut provoquer une irritation des yeux, de la peau et des voies respiratoires. Une exposition prolongée peut provoquer des étourdissements et des maux de tête. |
Méthodes de synthèse du n-pentane
Le raffinage du pétrole est la principale méthode de production de n-pentane. Il s’agit d’un hydrocarbure à chaîne droite et l’un des principaux composants de l’essence. Il existe plusieurs méthodes pour la synthèse du n-Pentane :
Craquage du pétrole : Pour obtenir du n-pentane à partir du pétrole, nous pouvons le craquer par distillation fractionnée, un processus qui chauffe le pétrole brut pour séparer ses composants en fonction de leur point d’ébullition. Nous pouvons alors séparer le n-pentane des autres hydrocarbures dont le point d’ébullition est compris entre 30 et 40°C.
Isomérisation : L’isomérisation est le processus de conversion d’un hydrocarbure en un autre ayant la même formule moléculaire mais une structure différente. L’isomérisation des pentènes produit du n-pentane comme sous-produit. L’industrie pétrochimique utilise couramment cette méthode.
Hydrogénation : L’hydrogénation des pentènes est une autre méthode de synthèse du n-pentane. Pour synthétiser le n-pentane à partir de pentènes, nous pouvons réagir avec de l’hydrogène gazeux en présence d’un catalyseur, qui est généralement un métal comme le nickel ou le platine. La réaction produit du n-pentane comme sous-produit.
Déshydratation du 1-pentanol : On peut également synthétiser le n-pentane à partir du 1-pentanol en le déshydratant à l’aide d’un catalyseur acide comme l’acide sulfurique . Cette réaction produit du n-pentène, que l’on peut ensuite hydrogéner pour obtenir du n-pentane.
Utilisations du n-pentane
Le n-pentane a diverses utilisations dans diverses industries. Voici quelques-unes des principales applications :
- Solvant : Utilisé comme solvant pour les huiles, les cires et les résines dans l’industrie de la peinture et des revêtements. Les adhésifs, les encres et le caoutchouc l’utilisent comme solvant.
- Agent gonflant : utilisé comme agent gonflant dans la production de mousse isolante, telle que le polystyrène expansé (EPS) et le polystyrène extrudé (XPS).
- Intermédiaire chimique : utilisé comme intermédiaire chimique dans la production d’autres produits chimiques, tels que le pentanol, l’acide pentanoïque et le pentanal.
- Carburant : utilisé comme carburant dans certains mélanges d’essence, généralement comme composant de mélange pour augmenter les niveaux d’octane.
- Étalon d’étalonnage : utilisé comme étalon d’étalonnage en chromatographie en phase gazeuse.
- Extraction : Utilisé dans l’extraction d’huiles comestibles, comme l’huile de soja, et dans l’extraction de produits naturels, comme les huiles essentielles de plantes.
- Recherche en laboratoire : Utilisé dans la recherche en laboratoire comme solvant et comme matériau de référence pour la chromatographie en phase gazeuse.
Des questions:
Q : La formule moléculaire du pentane est c5h12. quelle est la formule moléculaire d’un isomère du pentane ?
R : Le 2-méthylbutane (également connu sous le nom d’isopentane) a la formule moléculaire C5H12 et est un isomère du pentane.
Q : Le pentane est-il polaire ?
R : Non, le pentane est apolaire car il ne contient que des liaisons carbone-carbone et carbone-hydrogène non polaires et a une forme moléculaire symétrique.
Q : Lequel des éléments suivants est le plus soluble dans l’eau ? acide acétique pentanol acide butanoïque pentanal
R : L’acide acétique est le plus soluble dans l’eau en raison de sa capacité à former des liaisons hydrogène avec les molécules d’eau.
Q : Le pentane est-il soluble dans l’eau ?
R : Non, le pentane est insoluble dans l’eau en raison de sa nature non polaire et de son incapacité à former des liaisons hydrogène avec les molécules d’eau.
Q : Le n-pentane a-t-il une liaison hydrogène ?
R : Non, le n-pentane n’a pas de liaison hydrogène car il lui manque des atomes d’hydrogène liés à des atomes électronégatifs tels que l’oxygène, l’azote ou le fluor.
