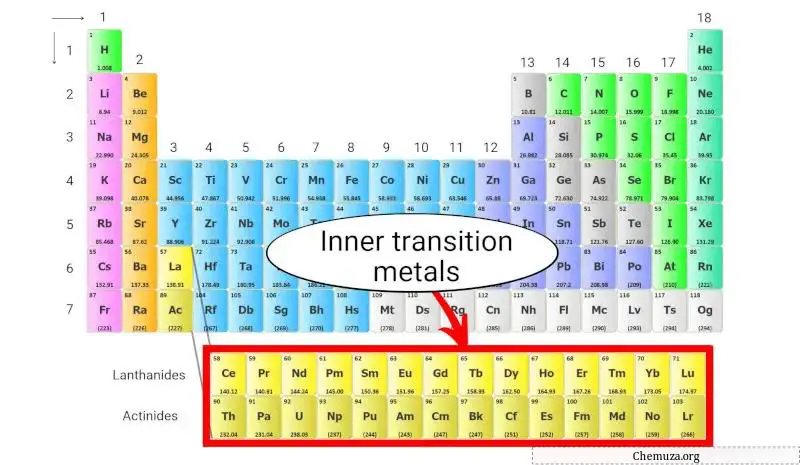
Les métaux de transition internes sont un groupe d’éléments chimiques situés dans les deux rangées inférieures du tableau périodique , juste en dessous du bloc principal des métaux de transition .
Les métaux de transition internes sont divisés en deux groupes :
- Les lanthanides , qui ont des numéros atomiques allant de 57 à 71, et
- Actinides , qui ont des numéros atomiques allant de 89 à 103.
Explorons davantage les éléments de transition internes du tableau périodique.
Que sont les métaux de transition internes ? Et pourquoi sont-ils placés en bas ?
Les métaux de transition internes constituent le groupe d’éléments placés au bas du tableau périodique.
Ces métaux de transition internes font uniquement partie des métaux de transition et possèdent également des propriétés similaires à celles des métaux de transition. Mais ils sont placés dans la section intérieure en prolongement du groupe 3.
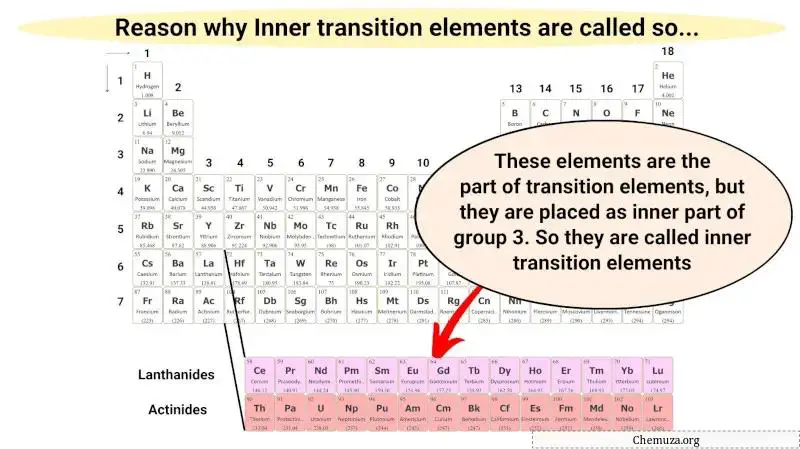
Par conséquent, ces éléments métalliques sont appelés métaux de transition internes.
Pourquoi sont-ils placés en bas du tableau périodique ?
Si les métaux de transition internes sont placés comme une extension du groupe 3, alors le tableau périodique semblerait très long (comme indiqué ci-dessous).

Ainsi afin de pouvoir le faire tenir sur un papier de format A4, les 2 rangées de métaux de transition intérieures sont placées en bas.
En outre, ces éléments de transition internes ont leurs électrons de valence dans l’ orbitale f , grâce à quoi ces éléments présentent des propriétés chimiques similaires.
C’est pour ces raisons que les métaux de transition internes sont placés au bas du tableau périodique.
Liste des métaux de transition internes
La liste des métaux de transition internes est donnée ci-dessous.
| Numéro atomique | Symbole | Nom et symbole de l’élément |
| 57 | La | Lanthane |
| 58 | Ce | Cérium |
| 59 | Pr | Praséodyme |
| 60 | sd | Néodyme |
| 61 | PM | Prométhium |
| 62 | Petit | Samarium |
| 63 | UE | Europium |
| 64 | D.ieu | Gadolinium |
| 65 | tuberculose | Terbium |
| 66 | Dy | Dysprosium |
| 67 | Ho | Holmium |
| 68 | Euh | Erbium |
| 69 | Tm | Thulium |
| 70 | Yb | Ytterbium |
| 71 | Lu | Lutétium |
| 89 | Ac | Actinium |
| 90 | Ème | Thorium |
| 91 | Pennsylvanie | Protactinium |
| 92 | U | Uranium |
| 93 | Np | Neptunium |
| 94 | Pu | Plutonium |
| 95 | Suis | Américium |
| 96 | Cm | Curium |
| 97 | BK | Berkélium |
| 98 | Cf. | Californie |
| 99 | Es | Einsteinium |
| 100 | FM | fermium |
| 101 | Maryland | Mendélévium |
| 102 | Non | Nobelium |
| 103 | G / D | Lawrence |
Faits sur les métaux de transition internes
Voici quelques faits intéressants sur les métaux de transition internes :
- Il existe deux types de métaux de transition internes : les lanthanides et les actinides. Les lanthanides sont les 15 éléments dont les numéros atomiques vont de 57 ( lanthane ) à 71 ( lutétium ), tandis que les actinides sont les 15 éléments dont les numéros atomiques vont de 89 ( actinium ) à 103 ( lawrencium ).
- Les métaux de transition internes ont des configurations électroniques uniques en raison de la présence d’orbitales f. Cela se traduit par des propriétés chimiques et physiques inhabituelles, telles que des points de fusion et d’ébullition élevés, la formation d’ions complexes et le paramagnétisme.
- La plupart des métaux de transition internes sont radioactifs et certains ont été utilisés dans des réacteurs nucléaires et des armes.
- Les métaux de transition internes sont importants dans la technologie et l’industrie. Par exemple, le néodyme et le samarium sont utilisés pour fabriquer de puissants aimants [1] et le cérium est utilisé dans les pots catalytiques pour réduire les émissions des véhicules. [2]
- Les lanthanides sont également appelés « éléments des terres rares » car ils sont relativement rares dans la croûte terrestre. Cependant, ils ne sont pas réellement rares et se retrouvent dans de nombreux minéraux.
- Les actinides sont tous radioactifs et certains, comme l’uranium et le plutonium , sont importants pour l’énergie nucléaire et les armes. Cependant, ils présentent également des risques environnementaux et sanitaires en raison de leur radioactivité.
- Les métaux de transition internes sont connus depuis l’Antiquité et étaient utilisés pour les bijoux et la décoration. Cependant, ils n’ont été largement étudiés ou compris qu’au XX e siècle.
Propriétés des métaux de transition internes
Voici quelques propriétés des métaux de transition internes :
- Configuration électronique : les métaux de transition internes ont des orbitales f partiellement remplies, ce qui leur confère des configurations électroniques uniques et des propriétés chimiques et physiques inhabituelles.
- Points de fusion et d’ébullition élevés : les métaux de transition internes ont des points de fusion et d’ébullition élevés en raison de la forte liaison métallique résultant de la présence d’électrons non appariés dans les orbitales f.
- Paramagnétisme : les métaux de transition internes sont paramagnétiques, ce qui signifie qu’ils sont attirés par un champ magnétique en raison de la présence d’électrons non appariés dans les orbitales f.
- Formation d’ions complexes : les métaux de transition internes peuvent former des ions complexes en raison de la disponibilité d’orbitales f vides, qui peuvent accueillir des électrons provenant d’autres atomes ou molécules.
- Radioactivité : De nombreux métaux de transition internes sont radioactifs en raison de la présence d’isotopes instables dans leurs noyaux.
- États d’oxydation : les métaux de transition internes présentent une gamme d’états d’oxydation, y compris des états d’oxydation élevés, en raison de la disponibilité de plusieurs électrons de valence dans les orbitales f.
- Propriétés chimiques similaires : Les lanthanides et les actinides ont des propriétés chimiques similaires, ce qui les rend difficiles à séparer les uns des autres.
- Lustre métallique : les métaux de transition internes sont généralement brillants et ont un éclat métallique en raison de leur haute réflectivité de la lumière.
Utilisations des métaux de transition internes
Les métaux de transition internes ont un large éventail d’utilisations en raison de leurs propriétés uniques. Certaines des utilisations des métaux de transition internes sont :
- Énergie nucléaire : De nombreux métaux de transition internes, en particulier les actinides comme l’uranium, sont utilisés comme combustible pour les réacteurs nucléaires et les armes.
- Aimants : les lanthanides comme le néodyme, le samarium et le gadolinium sont utilisés pour fabriquer de puissants aimants pour diverses applications, notamment les disques durs d’ordinateurs, les éoliennes et les appareils IRM.
- Éclairage : les lanthanides comme l’europium et le terbium sont utilisés pour fabriquer des luminophores pour l’éclairage fluorescent et LED. [3]
- Catalyse : les lanthanides comme le cérium sont utilisés comme catalyseurs dans de nombreux processus industriels, notamment le raffinage du pétrole et le contrôle de la pollution.
- Fabrication du verre : les lanthanides comme l’erbium et l’ytterbium sont utilisés pour colorer le verre, tandis que le cérium est utilisé pour polir le verre.
- Imagerie médicale : les lanthanides comme le gadolinium et le terbium sont utilisés dans les agents de contraste pour les IRM. [4]
- Électronique : les lanthanides comme le dysprosium et le terbium sont utilisés dans les appareils électroniques, tels que les filtres à micro-ondes et les écrans LCD.
- Défense : les métaux de transition internes sont utilisés dans les technologies de défense, notamment les armes nucléaires et les munitions perforantes.
Résumé
Les métaux de transition internes sont un groupe d’éléments chimiques situés dans les deux rangées inférieures du tableau périodique, juste en dessous du bloc principal des métaux de transition.
Ils sont divisés en deux groupes : les Lanthanides et les Actinides, qui ont respectivement des numéros atomiques allant de 57 à 71 et de 89 à 103.
L’emplacement des métaux de transition internes se trouve au bas du tableau périodique car leurs électrons de valence se trouvent dans l’orbitale f, qui présente des propriétés chimiques similaires.
Les métaux de transition internes ont des points de fusion et d’ébullition élevés, une formation d’ions complexes et un paramagnétisme. Ils présentent également une gamme d’états d’oxydation, y compris des états d’oxydation élevés, en raison de la disponibilité de plusieurs électrons de valence dans les orbitales f.
