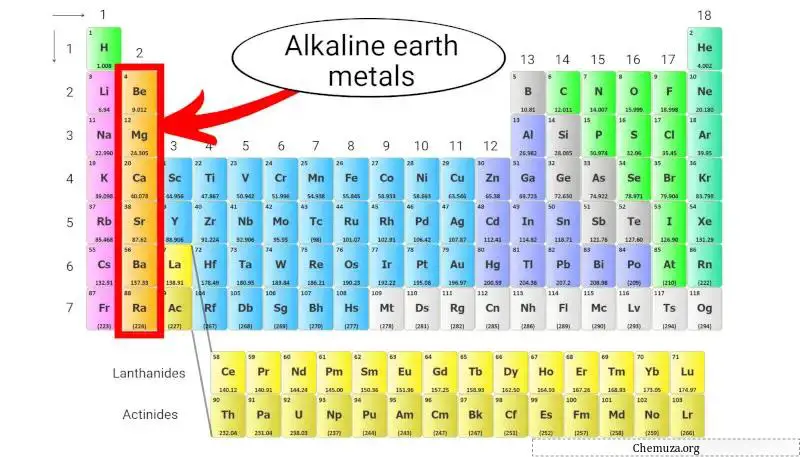
Les métaux alcalino-terreux sont un groupe d’éléments situés dans la deuxième colonne du tableau périodique . Ils comprennent le béryllium (Be), le magnésium (Mg), le calcium (Ca), le strontium (Sr), le baryum (Ba) et le radium (Ra).
Ces métaux ont deux électrons dans leur couche la plus externe, [1] ce qui les rend chimiquement réactifs mais pas aussi réactifs que les métaux alcalins , qui se trouvent dans la première colonne.
Explorons davantage les métaux alcalino-terreux du tableau périodique.
Que sont les métaux alcalino-terreux ?

Les métaux alcalino-terreux font partie du groupe 2 du tableau périodique et présentent deux caractéristiques particulières.
- Lorsqu’ils réagissent avec l’eau, ils produisent des hydroxydes de nature alcaline ou basique.
- Leurs minéraux oxydés (BeO, magnésite, MgO, béryl, etc.) se trouvent principalement dans la croûte terrestre et sont stables à la chaleur.
Explication
Lorsque les métaux alcalino-terreux (Mg, Ca, Sr, Ba et Ra) réagissent avec l’eau, ils forment des hydroxydes de nature alcaline (ou basique). [2]
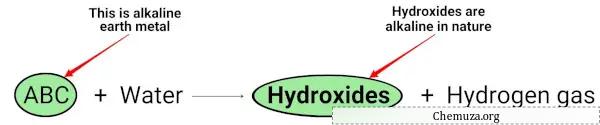
Vous pouvez voir dans l’équation chimique ci-dessus que les métaux alcalins donnent des hydroxydes qui sont de nature basique (ayant un pH > 7) et libèrent de l’hydrogène gazeux.
Par exemple:
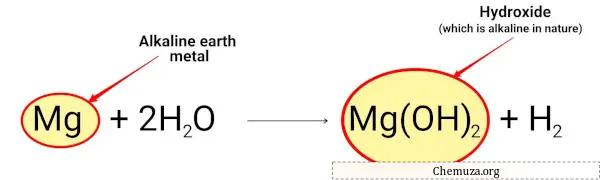
Le magnésium réagit avec l’eau et forme de l’hydroxyde de magnésium de nature alcaline.
De plus, ces métaux se trouvent principalement dans la croûte terrestre (sous forme d’oxydes) et ces minéraux oxydés sont stables à la chaleur. [2]
Ces deux critères donnent à ces métaux leur appellation de « métaux alcalino-terreux ».
(Remarque : il est important de noter que le béryllium, qui est également un élément du groupe 2, ne forme pas de solution alcaline lorsqu’il réagit avec l’eau. Au lieu de cela, ses hydroxydes présentent un comportement amphotère, ce qui signifie qu’ils peuvent se comporter comme un acide ou une base. Par conséquent, le béryllium n’est pas considéré comme un métal alcalino-terreux même s’il appartient au même groupe.)
Qu’est-ce qui est commun à tous les métaux alcalino-terreux ?
Les métaux alcalino-terreux partagent plusieurs traits communs.
Par exemple, ils ont tous deux électrons de valence dans leur niveau d’énergie le plus externe, ce qui les rend assez réactifs.
Cette réactivité est due à la tendance à perdre ces électrons lors de réactions chimiques, entraînant la formation de cations de charge +2.
De plus, tous les métaux alcalino-terreux ont un aspect blanc argenté et brillant.

Ce sont donc les deux principales choses que les métaux alcalino-terreux ont en commun.
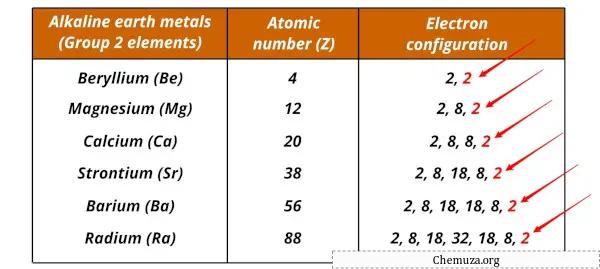
Liste des métaux alcalins et leurs configurations électroniques
Les métaux alcalino-terreux et leurs configurations électroniques sont indiqués ci-dessous.
| Élément | Configuration électronique |
| Béryllium (Be) | [Il] 2s 2 |
| Magnésium (Mg) | [Ne] 3s 2 |
| Calcium (Ca) | [Ar] 4s 2 |
| Strontium (Sr) | [Kr] 5s 2 |
| Baryum (Ba) | [Xe] 6s 2 |
| Radium (Ra) | [Rn] 7s 2 |
Tendances périodiques des métaux alcalino-terreux
À mesure que l’on descend dans le groupe des métaux alcalino-terreux du tableau périodique, les tendances suivantes peuvent être observées :
- Valence : Tous les métaux alcalino-terreux ont la même valence de +2. Il n’y a donc aucun changement de valence à mesure que nous descendons dans le groupe.
- Taille atomique : La taille atomique des métaux alcalino-terreux augmente à mesure que l’on descend dans le groupe. En effet, le nombre de couches électroniques (ou orbites ) augmente et l’ effet de protection des électrons internes réduit l’attraction entre le noyau et les électrons les plus externes.
- Caractère métallique : Le caractère métallique des métaux alcalino-terreux augmente à mesure que l’on descend dans le groupe. En effet, les atomes deviennent plus gros et contiennent plus d’électrons, ce qui les rend plus facilement capables de perdre des électrons et de former des ions positifs.
- Électronégativité : L’ électronégativité des métaux alcalino-terreux diminue à mesure que l’on descend dans le groupe. En effet, les atomes deviennent plus gros et ont plus de couches électroniques, ce qui rend plus difficile pour eux d’attirer les électrons vers eux.
- Affinité électronique : L’affinité électronique des métaux alcalino-terreux est généralement faible et elle diminue à mesure que l’on descend dans le groupe.
- Énergie d’ionisation : L’énergie d’ionisation des métaux alcalino-terreux diminue à mesure que l’on descend dans le groupe. En effet, les atomes les plus gros ont plus de couches électroniques et les électrons les plus externes sont plus éloignés du noyau, ce qui les rend plus faciles à éliminer.
Résumé
Les métaux alcalino-terreux comprennent le béryllium, le magnésium, le calcium, le strontium, le baryum et le radium. Ils ont deux électrons dans leur couche la plus externe, ce qui les rend réactifs mais moins que les métaux alcalins.
Ces métaux produisent des hydroxydes alcalins lorsqu’ils réagissent avec l’eau et contiennent des minéraux oxydés stables à la chaleur. Les principales caractéristiques communes à tous les métaux alcalino-terreux sont le fait d’avoir deux électrons de valence, d’être blanc argenté et brillant, et de former des cations avec une charge +2.
La valence reste la même à mesure que l’on descend dans le groupe, mais la taille atomique et le caractère métallique augmentent, tandis que l’électronégativité, l’affinité électronique et l’énergie d’ionisation diminuent.
