Le métabisulfite de sodium (Na2S2O5) est un composé chimique utilisé comme conservateur et antioxydant dans les aliments et les boissons. Il peut également être utilisé comme désinfectant et agent de blanchiment dans diverses industries.
| Nom UICPA | Pyrosulfite de sodium |
| Formule moléculaire | Na2S2O5 |
| Numero CAS | 7681-57-4 |
| Synonymes | Disulfite disodique, acide pyrosulfureux, sel disodique, pyrosulfite de sodium, disulfite de sodium |
| InChI | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Propriétés du métabisulfite de sodium
Formule de métabisulfite de sodium
La formule chimique du métabisulfite de sodium est Na2S2O5. Il est composé de deux ions sodium (Na+) et d’un ion disulfite (S2O5-2). Le composé est une poudre cristalline blanche ou jaunâtre, soluble dans l’eau et dégageant une odeur âcre.
Métabisulfite De Sodium Masse molaire
La masse molaire de Na2S2O5 est 190,107 g/mol. Cette valeur est calculée en additionnant les masses atomiques des éléments du composé, qui sont de 22,99 g/mol pour le sodium, 32,06 g/mol pour le soufre et 15,99 g/mol pour l’oxygène. La masse molaire est une propriété importante qui aide à déterminer la quantité d’une substance nécessaire à une réaction chimique.
Point d’ébullition du métabisulfite de sodium
Na2S2O5 a un point de fusion élevé de 150 °C, mais il se décompose avant de pouvoir bouillir. Le composé se décompose en dioxyde de soufre (SO2) et en sulfite de sodium (Na2SO3) à une température d’environ 150 °C. Par conséquent, le point d’ébullition du Na2S2O5 n’est pas applicable.
Métabisulfite de sodium Point de fusion
Le point de fusion du Na2S2O5 est de 150 °C. À cette température, le composé subit un changement de phase d’un solide à un liquide. Le point de fusion est une propriété physique importante qui aide à identifier et caractériser une substance.
Densité du métabisulfite de sodium g/mL
La densité de Na2S2O5 est de 1,48 g/mL. C’est un composé relativement dense qui coule dans l’eau. La densité d’une substance est la masse par unité de volume et constitue une propriété physique importante qui aide à déterminer la quantité d’une substance dans un volume donné.
Métabisulfite de Sodium Poids moléculaire
Le poids moléculaire de Na2S2O5 est de 190,107 g/mol. C’est la somme des poids atomiques de tous les atomes du composé. Le poids moléculaire est une propriété importante qui aide à calculer la quantité d’une substance nécessaire à une réaction chimique.
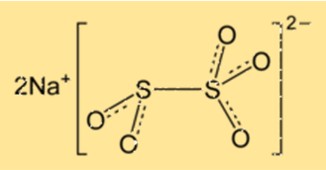
Structure du métabisulfite de sodium
Na2S2O5 a une structure cristalline et appartient au système cristallin orthorhombique. Le réseau cristallin est composé d’ions sodium et d’ions disulfite disposés selon un motif répétitif. Le composé a une géométrie moléculaire tétraédrique, avec les atomes de soufre au centre du tétraèdre.
Solubilité du métabisulfite de sodium
Na2S2O5 est hautement soluble dans l’eau, avec une solubilité de 54 g/100 mL à 25 °C. Il est également soluble dans le glycérol et légèrement soluble dans l’éthanol. La solubilité d’une substance est une propriété importante qui détermine sa capacité à se dissoudre dans un solvant donné.
| Apparence | Poudre cristalline blanche ou jaunâtre |
| Gravité spécifique | 1,48 |
| Couleur | Blanc à jaunâtre |
| Odeur | Âcre |
| Masse molaire | 190,107 g/mole |
| Densité | 1,48 g/ml |
| Point de fusion | 150 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 54 g/100 mL à 25 °C |
| Solubilité | Soluble dans le glycérol et légèrement soluble dans l’éthanol |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | 7.2 |
| pH | 4,5 (solution à 5 %) |
Sécurité et dangers du métabisulfite de sodium
Na2S2O5 peut être dangereux s’il n’est pas manipulé correctement. C’est un agent réducteur puissant qui peut provoquer une irritation de la peau, des yeux et du système respiratoire en cas d’exposition. L’ingestion du composé peut entraîner de graves troubles gastro-intestinaux. Na2S2O5 doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles. Il ne doit pas être mélangé avec des acides forts, des oxydants puissants ou des agents réducteurs. Des équipements de protection, tels que des gants, des lunettes et des masques respiratoires, doivent être utilisés lors de la manipulation du composé. Des mesures d’urgence, telles que des douches oculaires et des extincteurs, doivent être facilement disponibles en cas d’accident.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Portez des vêtements et des gants de protection. Ne pas ingérer. Utiliser avec une ventilation adéquate. |
| Numéros d’identification de l’ONU | ONU 2676 |
| Code SH | 2832.10.00 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) : 1 000 mg/kg ; CL50 (inhalation, rat) : 11 mg/L (4 heures) |
Méthodes de synthèse du métabisulfite de sodium
On peut synthétiser Na2S2O5 par diverses méthodes, notamment en faisant réagir du bisulfite de sodium avec du dioxyde de soufre en présence d’un agent oxydant tel que le peroxyde d’hydrogène . Le processus chauffe le produit d’addition de bisulfite de sodium et de dioxyde de soufre pour former Na2S2O5.
Une autre méthode implique la réaction de l’hydroxyde de sodium avec du dioxyde de soufre gazeux, suivie de l’ajout d’acide sulfurique pour former du sulfate de sodium et du Na2S2O5.
Une autre méthode de synthèse implique la réaction du carbonate de sodium avec du dioxyde de soufre, puis le chauffage du sulfite de sodium obtenu en présence d’air. Ce processus produit du sulfate de sodium et du Na2S2O5.
En présence d’un agent oxydant tel que le peroxyde d’hydrogène ou l’acide nitrique, Na2S2O5 peut être préparé en faisant réagir le soufre avec le sulfite de sodium.
Dans l’industrie, la méthode la plus courante de synthèse de Na2S2O5 consiste à faire réagir du bisulfite de sodium avec du dioxyde de soufre en présence d’un catalyseur tel que le dioxyde de manganèse. Le chauffage du produit d’addition bisulfite de sodium/dioxyde de soufre forme Na2S2O5.
Utilisations du métabisulfite de sodium
Na2S2O5 a diverses utilisations dans plusieurs industries en raison de ses fortes propriétés réductrices et de sa capacité à agir comme conservateur et antioxydant. Certaines des utilisations courantes du Na2S2O5 comprennent :
- Industrie alimentaire et des boissons : largement utilisé comme conservateur et antioxydant dans les produits alimentaires et les boissons tels que le vin, la bière, les jus de fruits et les fruits secs. Cela aide à prévenir la détérioration et l’oxydation de ces produits, prolongeant ainsi leur durée de conservation.
- Industrie pharmaceutique : Utilisé comme antioxydant dans divers produits pharmaceutiques tels que les crèmes, les pommades et les comprimés. Il permet de prévenir la dégradation de ces produits due à l’exposition à l’air et à la lumière.
- Traitement de l’eau : Utilisé pour déchlorer l’eau dans les usines de traitement de l’eau. Il permet d’éliminer l’excès de chlore et de chloramines, qui peuvent être nocifs pour la vie aquatique.
- Photographie : Utilisé comme révélateur et fixateur photographique dans l’industrie de la photographie. Il aide à réduire les ions d’argent en argent métallique, formant ainsi l’image photographique.
- Industrie textile : Utilisé comme agent réducteur dans l’industrie textile pour les procédés de teinture et d’impression. Il aide à éliminer l’excès d’oxygène de la solution de teinture, améliorant ainsi l’intensité et l’uniformité de la couleur.
Des questions:
Q : Où puis-je acheter du métabisulfite de sodium localement ?
R : Na2S2O5 peut généralement être trouvé dans les magasins de produits chimiques ou chez les détaillants en ligne. Il peut également être disponible dans certains magasins d’alimentation spécialisés, car il est couramment utilisé comme conservateur dans l’industrie alimentaire.
Q : Où acheter du métabisulfite de sodium ?
R : Na2S2O5 peut être acheté dans les magasins de produits chimiques ou chez les détaillants en ligne spécialisés dans les produits chimiques. Il peut également être disponible dans certains magasins d’alimentation spécialisés.
Q : Le métabisulfite de sodium est-il sans danger ?
R : Na2S2O5 peut être dangereux s’il n’est pas manipulé correctement. Il est important de porter un équipement de protection approprié et de suivre les consignes de sécurité lors de la manipulation de ce composé. Il peut provoquer une irritation de la peau et des yeux et peut également libérer du dioxyde de soufre toxique s’il est mélangé à de l’acide. Cependant, lorsqu’il est utilisé à des concentrations appropriées et manipulé avec soin, le Na2S2O5 est généralement considéré comme sûr pour les utilisations prévues.
Q : Pouvez-vous transformer le bisulfate de sodium en métabisulfite de sodium ?
R : Oui, le bisulfate de sodium (NaHSO4) peut être converti en Na2S2O5 en le chauffant à haute température en présence d’un agent oxydant, tel que le peroxyde d’hydrogène. La réaction entraîne la libération d’eau et la formation de Na2S2O5.
Q : Quelle est la différence entre le bisulfite de sodium et le métabisulfite de sodium ?
R : La principale différence entre NaHSO3 et Na2S2O5 est leur structure chimique. Le bisulfite de sodium possède un groupe sulfite (-SO3) et un ion hydrogène (H+), tandis que Na2S2O5 possède deux groupes sulfite (-SO3) liés entre eux. Na2S2O5 est également plus stable et a une durée de conservation plus longue que le bisulfite de sodium.
Q : Quel est le nombre d’oxydation du S dans Na2S2O5 ?
R : Le nombre d’oxydation du soufre (S) dans Na2S2O5 est de +5.
Q : Comment trouver une concentration de IO3- à partir de KIO3 et Na2S2O5 ?
R : La concentration d’IO3- peut être déterminée par titrage avec une concentration connue de thiosulfate de sodium (Na2S2O3), en utilisant l’amidon comme indicateur. La réaction entre KIO3 et Na2S2O5 produit de l’iode (I2), qui réagit avec Na2S2O3 pour former NaI et Na2S4O6. En mesurant le volume de Na2S2O3 nécessaire pour réagir avec l’iode, la concentration de IO3- peut être calculée.
Q : Quels ions contiennent Na2S2O5 ?
R : Na2S2O5 est composé de deux ions sodium (Na+) et d’un ion disulfite (-S2O5).
