Le métabisulfite de potassium (K2S2O5), également connu sous le nom de pyrosulfite de potassium, est un conservateur couramment utilisé dans la vinification et la transformation des aliments. Il agit en libérant du dioxyde de soufre, qui inhibe la croissance des bactéries et des levures, prolongeant ainsi la durée de conservation des produits.
| Nom de l’UICPA | Pyrosulfite de potassium |
| Formule moléculaire | K2S2O5 |
| Numero CAS | 16731-55-8 |
| Synonymes | Disulfite de potassium, acide pyrosulfureux, sel dipotassique, métabisulfite de potassium |
| InChI | InChI=1S/2K.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Propriétés du métabisulfite de potassium
Formule de métabisulfite de potassium
La formule chimique du métabisulfite de potassium est K2S2O5. Cela signifie que chaque molécule de métabisulfite de potassium contient deux ions potassium, deux atomes de soufre et cinq atomes d’oxygène. La formule est importante pour déterminer les propriétés chimiques et le comportement du K2S2O5 dans différentes réactions et processus.
Métabisulfite De Potassium Masse molaire
K2S2O5 a une masse molaire de 222,31 g/mol. Ceci est calculé en additionnant les masses atomiques de ses éléments constitutifs : deux atomes de potassium (39,10 g/mol chacun), deux atomes de soufre (32,06 g/mol chacun) et cinq atomes d’oxygène (16,00 g/mol chacun). . La masse molaire est importante pour déterminer la quantité de K2S2O5 nécessaire dans une réaction ou un processus particulier.
Point d’ébullition du métabisulfite de potassium
Le K2S2O5 n’a pas de point d’ébullition défini car il se décompose avant d’atteindre un point d’ébullition. À haute température, le K2S2O5 se décompose pour libérer du dioxyde de soufre, qui est l’ingrédient actif qui agit comme conservateur.
Métabisulfite de potassium Point de fusion
Le K2S2O5 a un point de fusion d’environ 190 °C (374 °F). A cette température, le composé solide fond et se transforme en un liquide clair. Le point de fusion est important pour déterminer les conditions appropriées de manipulation et de stockage du K2S2O5.
Densité du métabisulfite de potassium g/mL
La densité du K2S2O5 est d’environ 2,34 g/mL. Cela signifie qu’un volume donné de K2S2O5 pèsera 2,34 fois plus que le même volume d’eau. La densité est importante pour déterminer la quantité appropriée de K2S2O5 à utiliser dans un processus particulier.
Métabisulfite De Potassium Poids moléculaire
Le poids moléculaire du K2S2O5 est de 222,31 g/mol. Ceci est calculé en additionnant les masses atomiques de ses éléments constitutifs : deux atomes de potassium, deux atomes de soufre et cinq atomes d’oxygène. Le poids moléculaire est important pour déterminer la quantité de K2S2O5 nécessaire dans une réaction ou un processus particulier.
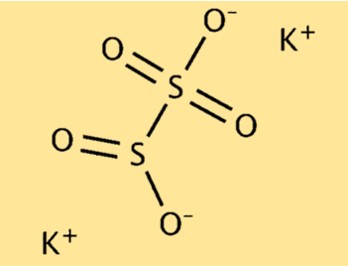
Structure du métabisulfite de potassium
K2S2O5 a une structure moléculaire composée de deux ions potassium (K+) et d’un ion pyrosulfite (S2O5^2-). L’ion pyrosulfite est formé de deux atomes de soufre et de cinq atomes d’oxygène. Les deux ions potassium sont attirés vers l’ion pyrosulfite chargé négativement, formant un composé ionique stable.
Solubilité du métabisulfite de potassium
K2S2O5 est soluble dans l’eau, l’alcool et le glycérol. Sa solubilité dans l’eau varie en fonction de la température et de la concentration. À température ambiante, il est très soluble dans l’eau, avec une solubilité d’environ 70 g/100 mL. Cependant, à des concentrations plus élevées, il peut devenir moins soluble et former des précipités.
| Apparence | Poudre cristalline blanche ou jaune pâle |
| Gravité spécifique | 2,34 à 20 °C |
| Couleur | Blanc à légèrement jaune |
| Odeur | Sulfureux, piquant |
| Masse molaire | 222,31 g/mole |
| Densité | 2,34 g/mL à 25 °C |
| Point de fusion | 190-240 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | Sans objet (solide) |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans l’éthanol et le glycérol, légèrement soluble dans l’éther |
| La pression de vapeur | Négligeable à température ambiante |
| Densité de vapeur | Sans objet (solide) |
| pKa | 4.34 |
| pH | 4,5-5,5 dans une solution à 10 % |
Sécurité et dangers du métabisulfite de potassium
Le K2S2O5 peut présenter des risques pour la sécurité s’il n’est pas manipulé correctement. Il peut provoquer une irritation de la peau, une irritation des yeux et des problèmes respiratoires en cas d’inhalation. Le contact direct avec la substance peut provoquer des rougeurs, des démangeaisons et des sensations de brûlure. Il peut également provoquer des problèmes digestifs en cas d’ingestion. La substance peut libérer du dioxyde de soufre gazeux toxique si elle est chauffée. Une ventilation adéquate est donc nécessaire pendant la manipulation et le stockage. Il est important de porter un équipement de protection individuelle approprié tel que des gants et des lunettes de sécurité lors de la manipulation du K2S2O5. Un stockage adéquat est également crucial, car il peut réagir avec les acides, les métaux et autres produits chimiques.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | Garder le récipient bien fermé et sec; Ne pas ingérer; Portez des vêtements de protection appropriés, des gants et une protection des yeux/du visage ; En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin ; En cas d’ingestion, consulter immédiatement un médecin et lui montrer l’emballage ou l’étiquette. |
| Numéros d’identification de l’ONU | ONU 2676 |
| Code SH | 2832.10.00 |
| Classe de danger | 8 – Substances corrosives |
| Groupe d’emballage | III |
| Toxicité | DL50 (rat, orale) – 2 000 mg/kg ; CL50 (rat, inhalation) – 17 ppm/4h |
Méthodes de synthèse du métabisulfite de potassium
Différentes méthodes peuvent synthétiser le K2S2O5.
Une méthode courante implique la réaction entre l’hydroxyde de potassium et le dioxyde de soufre. Le récipient de réaction combine les deux produits chimiques et les chauffe. Le gaz résultant traverse l’eau, produisant du sulfite de potassium . Le peroxyde d’hydrogène oxyde le sulfite de potassium, formant du sulfate de potassium. Le dioxyde de soufre réagit avec le sulfate de potassium pour donner du K2S2O5.
Une autre méthode implique la réaction du carbonate de potassium et du dioxyde de soufre. Le récipient de réaction mélange les deux produits chimiques et les chauffe. Le mélange produit un gaz qui traverse une solution de sulfite de potassium , créant ainsi du bisulfite de potassium. Le peroxyde d’hydrogène oxyde le bisulfite de potassium, formant du sulfate de potassium. Le dioxyde de soufre réagit avec le sulfate de potassium, produisant du K2S2O5.
Utilisations du métabisulfite de potassium
K2S2O5 a une large gamme d’applications dans diverses industries. Certaines utilisations courantes incluent :
- Conservation des aliments : utilisé comme conservateur alimentaire pour éviter la détérioration et prolonger la durée de conservation. Couramment utilisé dans la production de vin, de bière et de jus de fruits.
- Photographie : Utilisé en photographie comme révélateur et fixateur pour les films et les tirages.
- Industrie textile : Utilisé dans l’industrie textile pour éliminer les excès de teinture et de blanchiment des tissus.
- Traitement de l’eau : Utilisé comme produit chimique de traitement de l’eau pour éliminer le chlore et d’autres impuretés.
- Industrie pharmaceutique : Utilisé dans l’industrie pharmaceutique comme antioxydant pour prévenir la dégradation des médicaments.
- Extraction de l’or : utilisé dans l’extraction de l’or pour séparer l’or des autres métaux et impuretés.
- Fabrication de produits chimiques : Utilisé dans la fabrication de divers produits chimiques tels que les colorants, les résines et les plastiques.
- Industrie des pâtes et papiers : Utilisé dans l’industrie des pâtes et papiers pour blanchir les produits en papier.
Des questions:
Q : Quelle quantité de métabisulfite de potassium par gallon ?
R : La quantité de K2S2O5 nécessaire par gallon varie en fonction de l’utilisation prévue. Pour la vinification, la quantité recommandée est de 1/16 à 1/4 cuillère à café par gallon. Pour la fabrication du cidre, la quantité recommandée est de 1/4 cuillère à café par gallon. Il est important de respecter scrupuleusement la posologie recommandée pour garantir l’effet recherché et éviter une surconsommation qui peut être nocive.
Q : Quand dois-je utiliser le sorbate de potassium ou le métabisulfite de potassium ?
R : Le sorbate de potassium et le K2S2O5 sont tous deux utilisés comme conservateurs dans l’industrie alimentaire et des boissons. Le sorbate de potassium est utilisé pour empêcher la croissance des levures et des moisissures, tandis que le K2S2O5 est utilisé pour inhiber la croissance bactérienne et l’oxydation. Le sorbate de potassium est généralement utilisé dans les produits non acides, comme les sirops et les confitures, tandis que le K2S2O5 est utilisé dans les produits acides comme le vin et le cidre. Le choix entre les deux conservateurs dépend du produit spécifique et de ses exigences.
Q : Où acheter du métabisulfite de potassium ?
R : Le K2S2O5 peut être acheté dans les magasins de produits chimiques, chez les détaillants en ligne et dans les magasins de brassage amateur. Il est important de s’assurer que le produit est de haute qualité et destiné à l’usage prévu.
Q : Quelle quantité de métabisulfite de potassium par gallon de cidre ?
R : La quantité recommandée de K2S2O5 pour la fabrication du cidre est de 1/4 cuillère à café par gallon. Cette quantité est ajoutée après la fermentation pour empêcher l’oxydation et la croissance bactérienne, et pour préserver la saveur et la qualité du cidre.
Q : Quelle est la différence entre K2S2O5 et K2S2O8 ?
R : K2S2O5 et K2S2O8 sont tous deux des sels de potassium, mais ils ont des structures et des propriétés chimiques différentes. Le K2S2O5 est une poudre cristalline blanche utilisée comme conservateur et antioxydant, tandis que le K2S2O8 est un agent oxydant puissant utilisé dans les réactions chimiques telles que la synthèse organique et le traitement des eaux usées. La principale différence entre les deux réside dans leurs propriétés chimiques et leur utilisation prévue.
