L’acide acétique glacial est une forme hautement concentrée d’acide acétique, contenant généralement 99,5 à 100 % d’acide acétique. C’est un liquide incolore avec une odeur forte et âcre.
| Nom UICPA | Acide acétique |
| Formule moléculaire | C2H4O2 |
| Numero CAS | 64-19-7 |
| Synonymes | Acide acétique, acide éthanoïque, acide méthanecarboxylique, acide vinaigre |
| InChI | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) |
Propriétés de l’acide acétique
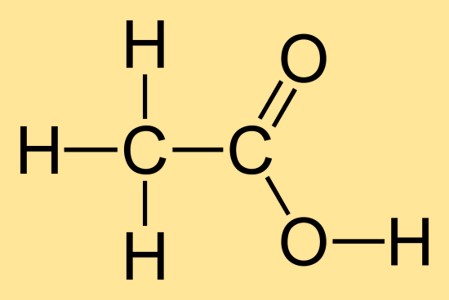
Masse molaire de Acide Acétique Glacial
La masse molaire de l’acide acétique glacial est de 60,05 g/mol. Cela signifie qu’une mole d’acide acétique pèse 60,05 grammes. La masse molaire est calculée en additionnant les poids atomiques de tous les atomes de la formule chimique, qui dans ce cas est C2H4O2.
Point d’ébullition de l’acide acétique glacial
Le point d’ébullition de l’acide acétique est de 118,1°C (244,58°F). Cela signifie qu’à cette température, l’acide acétique passe de l’état liquide à l’état gazeux. Le point d’ébullition d’une substance est affecté par divers facteurs tels que la pression et les impuretés, mais l’acide acétique a un point d’ébullition relativement bas par rapport aux autres composés organiques.
Point de fusion de l’acide acétique glacial
Le point de fusion de l’acide acétique est de 16,73°C et le point d’ébullition normal de 117,9°C.
Densité de l’acide acétique glacial g/ml
La densité de l’acide acétique est de 1,049 g/ml. Cela signifie qu’un millilitre d’acide acétique pèse 1,049 grammes. La densité d’une substance est affectée par sa température et sa pression, mais l’acide acétique est relativement dense par rapport aux autres composés organiques.
Poids moléculaire de l’acide acétique glacial
Le poids moléculaire de l’acide acétique glacial est de 60,05 g/mol. Cela signifie qu’une mole d’acide acétique pèse 60,05 grammes. Le poids moléculaire d’une substance est le même que sa masse molaire et il est calculé en additionnant les poids atomiques de tous les atomes de la formule chimique. Dans le cas de l’acide acétique, le poids moléculaire est C2H4O2.
| Apparence | Liquide clair et incolore |
| Gravité spécifique | 1,049 (20°C) |
| Couleur | Clair, incolore |
| Odeur | Fort, piquant, semblable à du vinaigre |
| Masse molaire | 60,052 g/mole |
| Densité | 1,05 g/cm3 (20°C) |
| Point de fusion | -16,6°C |
| Point d’ébullition | 118,1°C |
| Point d’éclair | 16,1°C (tasse fermée) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Miscible avec la plupart des solvants organiques |
| Pression de vapeur | 40,5 kPa (20 °C) |
| Densité de vapeur | 2,02 (air = 1) |
| PKa | 4,76 |
| PH | 2.4 (solution 1M) |
Sécurité et dangers de l’acide acétique glacial
L’acide acétique est une substance hautement corrosive et toxique qui peut provoquer de graves irritations de la peau et des yeux, des brûlures chimiques et des problèmes respiratoires s’il n’est pas manipulé correctement. Il doit toujours être manipulé avec des gants, des lunettes et une blouse de laboratoire pour se protéger du contact avec la peau et les yeux. Il doit également être stocké dans un endroit frais et sec, à l’abri de la chaleur et des flammes nues pour éviter d’éventuelles explosions. Il est important de toujours suivre les protocoles de sécurité appropriés et d’utiliser le bon EPI lors de la manipulation de l’acide acétique.
| Symbole de danger | Corrosif |
| Description de la sécurité | Peut provoquer de graves brûlures de la peau et des lésions oculaires |
| ID ONU | UN2689 |
| Code SH | 2915.11.00 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Haut |
Méthodes de production d’acide acétique glacial
L’acide acétique peut être préparé par oxydation d’éthanol ou d’acétaldéhyde. La méthode la plus courante est l’oxydation de l’éthanol à l’aide d’un catalyseur tel que le chromite de cuivre. La réaction est généralement réalisée à haute température (environ 200-250°C) et sous une haute pression d’oxygène. Le liquide résultant est ensuite distillé pour séparer l’acide acétique de tout éthanol ou eau restant. Une autre méthode est la carbonylation du méthanol à l’aide d’un catalyseur tel que le rhodium, qui produit de l’acide acétique comme sous-produit. Les deux méthodes nécessitent un contrôle strict des conditions de réaction pour obtenir une pureté élevée du produit final.
Utilisations de l’acide acétique glacial
L’acide acétique est utilisé en chimie analytique pour l’estimation de substances faiblement alcalines telles que les amides organiques. L’acide acétique est une base beaucoup plus faible que l’eau, donc l’amide se comporte comme une base forte dans ce milieu. L’acide acétique dilué est utilisé dans la conservation et la mise en conserve des cornichons et autres légumes. Il est également utilisé comme détartrant pour le nettoyage. Outre le nettoyage et la mise en conserve, l’acide acétique dilué peut traiter ou prévenir les infections bactériennes ou fongiques de l’oreille externe.
