탄산(H2CO3)은 이산화탄소가 물에 용해될 때 형성되며 해양 pH 조절과 암석 풍화 조절에 중요한 역할을 합니다.
| IUPAC 이름 | 탄산 |
| 분자식 | H2CO3 |
| CAS 번호 | 463-79-6 |
| 동의어 | 신맛이 나는 공기; 신맛이 나는 공기; H2CO3; 옥시다니우닐리덴메탄; 산성 탄산염; 하이드록시케톤; 디하이드록시메타논 |
| 인치 | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
탄산식
탄산의 화학식은 H2CO3이며 이는 수소 원자 2개, 탄소 원자 1개, 산소 원자 3개로 구성되어 있음을 나타냅니다. 이 공식은 또한 분자 내 원자의 비율을 보여 주며, 이는 탄산과 관련된 화학 반응의 화학량론을 결정하는 데 중요합니다.
몰 질량 of 탄산
탄산의 몰 질량은 약 62.03 g/mol입니다. 이산화탄소가 물에 용해될 때 형성되는 약산으로 바다의 pH를 조절하는 역할을 합니다. 탄산의 몰 질량은 용액에서 특정 pH에 도달하는 데 필요한 산의 양을 계산하고 물에 얼마나 많은 이산화탄소가 용해될 수 있는지 결정하는 데 중요합니다.
탄산의 끓는점
탄산은 끓는점에 도달하기 전에 물과 이산화탄소로 분해되기 때문에 끓는점이 잘 정의되어 있지 않습니다. 그러나 대기압에서 탄산은 약 333K(60°C)의 온도에서 물과 이산화탄소로 분해됩니다.
탄산의 녹는점
탄산은 또한 녹는점에 도달하기 전에 물과 이산화탄소로 분해되기 때문에 잘 정의된 녹는점이 없습니다. 그러나 대기압에서 탄산은 약 273K(-0.15°C)의 온도에서 물과 이산화탄소로 분해됩니다.
탄산의 밀도 g/ml
탄산의 밀도는 실온(25°C)에서 약 1.67g/mL입니다. 이 값은 용액의 농도, 환경의 온도 및 압력에 따라 달라질 수 있습니다.
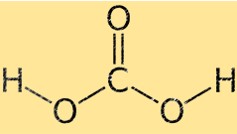
탄산의 구조
탄산은 중앙에 탄소 원자가 있고 사면체의 모서리에 4개의 주변 원자(산소 2개와 수소 2개)가 있는 사면체 분자 구조를 가지고 있습니다. 두 개의 산소 원자는 이중 결합으로 탄소 원자에 연결되고, 두 개의 수소 원자는 단일 결합으로 연결됩니다.
탄산의 분자량
탄산의 분자량은 62.03g/mol입니다. 이 값은 구성 원소인 수소(H), 탄소(C), 산소(O)의 원자량을 더하여 계산됩니다.
| 모습 | 무색의 액체 또는 결정성 고체 |
| 비중 | 1.67g/cm3 |
| 색상 | 무색 |
| 냄새가 나다 | 냄새 없는 |
| 몰 질량 | 62.03g/몰 |
| 밀도 | 실온(25°C)에서 1.67g/mL |
| 융합점 | 약 273K(-0.15°C)에서 분해됩니다. |
| 비점 | 약 333K(60°C)에서 분해됩니다. |
| 플래시 도트 | 해당 없음 |
| 물에 대한 용해도 | 완전히 용해됨 |
| 용해도 | 물, 에탄올, 메탄올에 용해됨 |
| 증기압 | 해당 없음 |
| 증기 밀도 | 해당 없음 |
| pKa | 3.6(첫 번째 해리) |
| pH | 5.6 (0.1M 용액 중) |
탄산 안전과 위험
탄산(H2CO3)은 일반적으로 안전한 것으로 간주되지만 특정 상황에서는 일부 위험을 초래할 수 있습니다. H2CO3에 노출되면 눈, 피부, 호흡기에 자극을 줄 수 있으며 기침, 천명음, 호흡 곤란을 유발할 수 있습니다. H2CO3를 섭취하면 배탈, 메스꺼움, 구토가 발생할 수 있습니다. H2CO3는 또한 약산이며 알루미늄 및 아연과 같은 특정 금속과 반응하여 가연성 수소 가스를 생성할 수 있습니다. H2CO3를 취급하거나 사용할 때는 보호복 착용과 적절한 환기를 포함하여 적절한 안전 예방 조치를 취해야 합니다. 노출된 경우 즉시 의사의 진료를 받아야 합니다.
| 위험 기호 | 없음 |
| 보안 설명 | 무독성 |
| UN 식별 번호 | 1824년 |
| HS 코드 | 28111990 |
| 위험 등급 | 8 – 부식성 물질 |
| 포장그룹 | III |
| 독성 | 낮은 독성 |
탄산 합성 방법
H2CO3는 다양한 방법으로 합성될 수 있습니다. 일반적인 방법은 촉매 존재 하에서 이산화탄소(CO2)와 물(H2O)을 반응시키는 것입니다. 수화라고 불리는 이 과정은 탄산을 생성합니다.
CO2 + H2O → H2CO3
탄산을 합성하는 또 다른 방법은 탄산칼슘(CaCO3)을 염산(HCl)과 같은 산과 반응시키는 것입니다. 산성화라고 불리는 이 과정은 탄산을 생성합니다.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
옥살산과 탄산나트륨(Na2CO3)과 같은 탄산염 사이의 반응으로 탄산이 합성됩니다. 이 과정을 통해 탄산과 옥살산나트륨과 같은 염이 생성됩니다.
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
솔베이 공정은 물이 있는 상태에서 탄산나트륨(Na2CO3)과 이산화탄소를 반응시켜 탄산과 중탄산나트륨을 생성합니다.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
전반적으로 탄산 합성에는 여러 가지 방법이 있으며 각각 고유한 장점과 한계가 있습니다. 방법 선택은 원하는 제품 순도, 원자재 가용성 및 필요한 생산 규모와 같은 요소에 따라 달라집니다.
탄산의 용도
탄산(H2CO3)은 산업, 의학 및 일상 생활에서 다양한 용도로 사용되는 다용도 화합물입니다. H2CO3의 주요 용도는 다음과 같습니다.
- 탄산 음료: H2CO3는 탄산음료, 맥주와 같은 탄산 음료의 특징적인 거품을 담당하는 화합물입니다.
- H2CO3는 수처리 및 식품 가공과 같은 다양한 산업 공정에서 pH를 완충합니다.
- 산소를 치환하고 연소를 방지하여 화재를 진압합니다.
- H2CO3는 특정 유형의 식품에서 박테리아와 곰팡이의 성장을 억제하여 식품을 보존합니다.
- 이는 특히 미네랄 침전물을 제거하는 순한 세척제 역할을 합니다.
- 의료 전문가들은 특정 피부 병변을 치료하고 폐 기능 테스트 중 기관지 수축을 유도하는 등 특정 용도로 H2CO3를 사용합니다.
- 용접공은 산화를 방지하고 보다 깨끗한 용접을 생성하기 위해 H2CO3를 보호 가스로 사용합니다.
전반적으로 탄산은 다양한 분야에서 광범위하게 응용되는 유용하고 다재다능한 화합물입니다.
질문:
Q: 탄산은 강산인가요?
A: 탄산은 약산입니다. 즉, 물에서 부분적으로만 해리되어 수소 이온(H+)과 중탄산염 이온(HCO3-)을 생성합니다. 산해리상수(Ka)가 상대적으로 낮아 물에서 완전히 해리되지 않음을 나타냅니다.
Q: 이산화탄소는 산성인가요?
A: 이산화탄소(CO2)는 물에서 수소 이온(H+)을 생성하지 않는 중성 화합물이므로 본질적으로 산성이 아닙니다. 그러나 CO2가 물에 용해되면 물 분자와 반응하여 약산인 탄산을 형성할 수 있습니다. 이 반응으로 인해 pH가 감소하여 용액이 더욱 산성화될 수 있습니다. 따라서 CO2 자체는 산성이 아니더라도 물과 반응하면 용액의 산성도에 기여할 수 있습니다.
