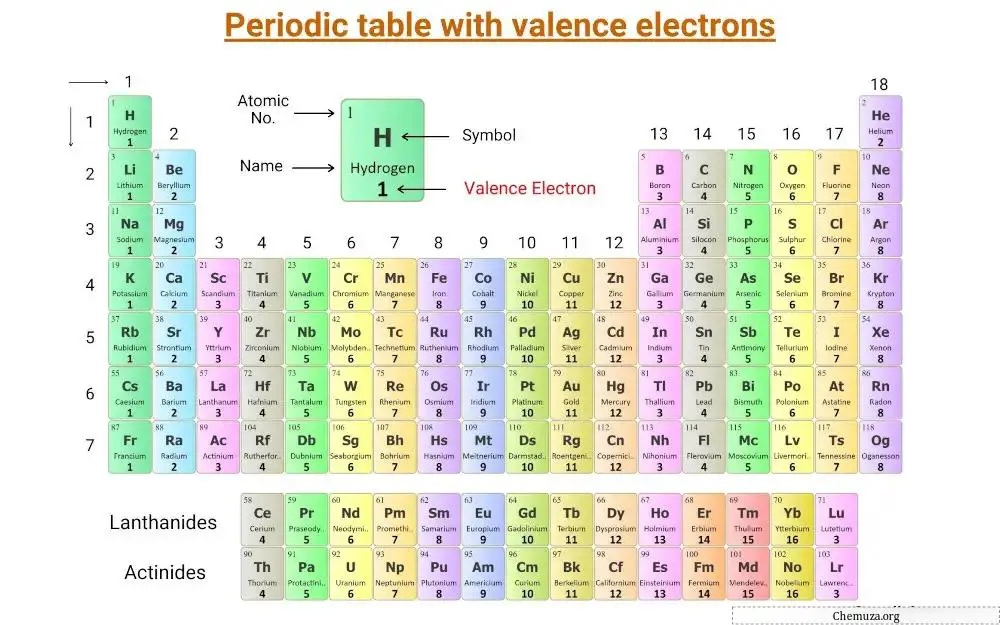
이것은 원자가 전자가 표시되어 있는 주기율표 입니다.
주족원소 와 전이 원소의 원자가전자 수와 함께 원자가전자의 개념을 이해해보자.
원자가 전자란 무엇입니까?
원자가 전자는 화학 결합에 관여하는 원자 의 가장 바깥 껍질 또는 에너지 수준 에 위치한 전자입니다.
예를 들어, 마그네슘은 가장 바깥쪽 궤도 에 2개의 전자를 가지고 있으므로 2개의 원자가 전자를 갖습니다. [1]
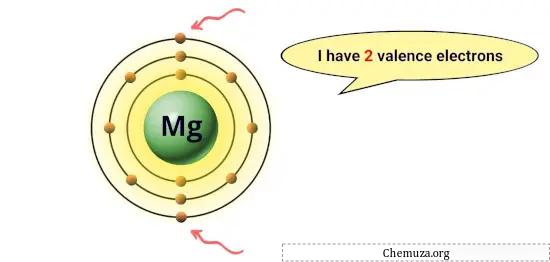
이러한 전자는 반응성 및 다른 원자와 형성할 수 있는 화학 결합 유형과 같은 요소의 화학적 특성을 담당합니다.
원자가 갖고 있는 원자가 전자의 수는 주기율표에서의 위치와 화학 결합을 형성하는 능력을 결정합니다.
주족 원소의 원자가 전자
대표 원소라고도 불리는 주요 족 원소는 주기율표의 1족, 2족, 13~18족에 위치합니다.
이 원소의 원자가 전자 수는 그룹 번호와 같습니다.
예를 들어, 리튬 및 나트륨 과 같은 1족 원소는 원자가 전자를 1개 갖고, 마그네슘 및 칼슘 과 같은 2족 원소는 2개의 원자가 전자를 갖습니다.
붕소 나 알루미늄 과 같은 13족 원소는 3개의 원자가 전자를 가지고 있습니다.
이러한 원자가 전자는 원소의 독특한 화학적 특성과 반응성을 담당합니다.
전이 및 내부 전이 요소의 원자가 전자
전이 원소 와 내부 전이 원소 의 원자가 전자는 주족 원소의 원자가 전자보다 결정하기가 더 복잡합니다.
실제로, 전이 요소의 하위층 d와 내부 전이 요소의 하위층 f는 불완전하게 채워져 있으며 외부 하위층 s에 매우 가깝습니다.
결과적으로, 전이 원소의 d 및 s 부껍질과 내부 전이 원소의 f 및 s 부껍질의 전자는 원자가 전자처럼 행동할 수 있습니다.
전이 원소의 경우 원자가 전자의 범위는 d-서브쉘 및 s-서브쉘 전자의 기여로 인해 3에서 12 사이일 수 있습니다. 어떤 경우에는 불완전한 d 궤도의 전자도 원자가 전자로 간주됩니다. [2]
마찬가지로 내부 전이 요소(또는 f-블록 요소)의 경우 f-서브쉘 및 s-서브쉘 전자의 기여로 인해 원자가 전자의 범위는 3에서 16까지입니다. [3] 불완전한 d 궤도의 전자는 일부 내부 전이 금속의 원자가 전자로 간주될 수도 있습니다.
전이 및 내부 전이 요소의 경우 원자가 전자는 비활성 가스 코어 외부 껍질에 존재하는 전자라는 점에 유의하는 것이 중요합니다.
