생석회라고도 알려진 산화칼슘은 녹는점이 높은 백색의 알칼리성 물질입니다. 물과 격렬하게 반응하여 수산화칼슘을 생성하고 상당한 열을 발생시킵니다. 시멘트 제조, 농업, 수처리 등 다양한 산업 분야에 사용됩니다.
| IUPAC 이름 | 산화칼슘 |
| 분자식 | CaO |
| CAS 번호 | 1305-78-8 |
| 동의어 | 생석회; 탄석회; 라임; 칼크스; 생석회; 칼슘(II) 산화물; 칼시아; 라임 조약돌; 석회암; 일산화칼슘; 퐁당 라임 |
| 인치 | InChI=1S/Ca.O |
산화칼슘의 성질
산화칼슘 포뮬러
산화칼슘의 화학식은 CaO로, 이는 칼슘 양이온(Ca2+)과 산화물 음이온(O2-)을 함유하고 있음을 나타냅니다. 산화칼슘의 공식은 칼슘 양이온과 산화 음이온이 강한 정전기력에 의해 결합되는 이온 특성을 반영합니다. 산화칼슘 공식은 다양한 화학 반응에서 화합물을 식별하고 분자량 및 기타 물리적 특성을 계산하는 데 사용됩니다.
산화칼슘 몰 질량
생석회라고도 알려진 산화칼슘의 몰 질량은 몰당 56,077g입니다. 이는 화합물을 구성하는 칼슘(40.078g/mol)과 산소(15.999g/mol)의 원자량에서 파생됩니다. 산화칼슘의 몰 질량은 특정 양의 생성물을 생성하는 데 필요한 반응물의 양을 결정하거나 용액의 농도를 계산하는 등 다양한 계산에 사용됩니다.
산화칼슘의 끓는점
산화칼슘은 끓는점이 아닌 고온에서 열분해되기 때문에 끓는점이 없습니다. 2572°C 이상의 온도에서 산화칼슘은 칼슘과 산소로 해리됩니다. 그러나 산화칼슘의 열분해를 사용하면 산업용으로 더 높은 순도와 반응성을 갖는 산화칼슘을 생산할 수 있습니다.
산화칼슘의 녹는점
산화칼슘의 녹는점은 2572°C로 고융점 물질입니다. 칼슘 양이온과 산화물 음이온이 강한 정전기력에 의해 함께 결합되는 이온 특성으로 인해 녹는점이 높습니다. 산화칼슘은 녹는점이 높기 때문에 강철 및 시멘트 제조와 같은 고온 응용 분야에도 유용합니다.
산화칼슘의 밀도 g/ml
산화칼슘의 밀도는 결정 구조와 순도에 따라 달라집니다. 산화칼슘의 일반적인 밀도는 벌크 재료의 경우 3.35g/mL인 반면, 이론적 밀도는 3.50g/mL입니다. 산화칼슘의 밀도가 낮은 이유는 다공성 구조로 인해 공기 중 수분을 흡수하고 무게와 부피가 증가하기 때문입니다.
산화칼슘의 분자량
공식 중량 또는 몰 질량이라고도 불리는 산화칼슘의 분자량은 몰당 56.077g입니다. 화합물을 구성하는 칼슘과 산소의 원자량을 더하여 계산됩니다. 산화칼슘의 분자량은 특정 양의 생성물을 생성하는 데 필요한 반응물의 양을 결정하거나 용액의 농도를 계산하는 등 다양한 계산에 사용됩니다.
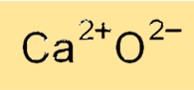
산화칼슘의 구조
산화칼슘은 칼슘 양이온과 산화물 음이온이 면심 입방 격자로 배열된 입방 결정 구조를 가지고 있습니다. 산화칼슘의 결정 구조는 염화나트륨 및 기타 이온 화합물의 결정 구조와 유사합니다. 산화칼슘의 이온 특성으로 인해 산화칼슘은 우수한 전기 절연체이자 전자 부품 제조에 중요한 재료가 됩니다.
| 모습 | 백색, 무취의 고체 |
| 비중 | 3.35g/cm3 |
| 색상 | 하얀색 |
| 냄새가 나다 | 냄새 없는 |
| 몰 질량 | 56.077g/몰 |
| 밀도 | 3.35g/cm3 |
| 융합점 | 2572°C |
| 비점 | 끓지 않고 열분해됨 |
| 플래시 도트 | 해당 없음 |
| 물에 대한 용해도 | 물과 반응하여 수산화칼슘을 형성함 |
| 용해도 | 물에 불용성, 산에 용해됨 |
| 증기압 | 무시할 만한 |
| 증기 밀도 | 해당 없음 |
| pKa | 해당 없음 |
| pH | 12-13 |
산화칼슘의 안전성과 위험성
생석회라고도 알려진 산화칼슘은 인간의 건강과 환경에 여러 가지 위험을 초래하는 반응성이 높고 부식성 물질입니다. 올바르게 취급하지 않으면 피부, 눈, 호흡기에 심한 자극과 화상을 일으킬 수 있습니다. 생석회 분진이나 증기를 흡입하면 호흡곤란, 기침, 호흡곤란을 일으킬 수 있습니다. 또한 물과 반응성이 매우 높으며 많은 양의 열을 방출하여 화상과 증기 폭발을 일으킬 수 있습니다. 생석회는 부적합한 물질로부터 멀리 떨어진 서늘하고 건조하며 통풍이 잘 되는 곳에 보관해야 합니다. 사고와 노출을 방지하려면 적절한 보호 장비와 취급 절차를 따라야 합니다.
| 위험 기호 | 부식성(C) |
| 보안 설명 | 장갑, 의복, 눈/얼굴 보호구를 착용하십시오. 주의하여 취급하고 보관하십시오. 흡입, 섭취, 피부 및 눈 접촉을 피하십시오. |
| UN 식별 번호 | UN1910 |
| HS 코드 | 2522.20.00 |
| 위험등급 | 8 – 부식성 물질 |
| 포장그룹 | II |
| 독성 | 매우 독성이 있음 |
산화칼슘 합성 방법
석회석의 열분해, 수산화칼슘과 열의 반응, 염화칼슘 의 전기분해로 산화칼슘이나 생석회가 합성됩니다.
생석회를 합성하는 가장 일반적인 방법은 석회를 석회가마에서 900~1000°C 정도의 고온으로 가열하는 것이다. 하소라고 알려진 이 과정은 이산화탄소를 방출하고 생석회를 남깁니다. 생석회를 가공하고 분쇄하면 다양한 용도로 사용할 수 있는 미세한 분말이 생성됩니다.
생석회를 합성하는 또 다른 방법은 소석회라고도 알려진 수산화칼슘을 고온으로 가열하는 것입니다. 탈수산화로 알려진 이 과정은 또한 물을 방출하고 생석회를 남깁니다.
염화칼슘 전기분해는 생석회를 합성하는 덜 일반적인 방법입니다. 염화칼슘을 물에 녹인 후 용액에 전류를 흘려 생석회와 염소가스를 발생시킵니다.
산화칼슘의 용도
생석회라고도 알려진 산화칼슘은 독특한 특성으로 인해 다양한 산업에서 많은 용도로 사용됩니다. 주요 용도 중 일부는 다음과 같습니다.
- 철강 생산: 철강 생산 시 플럭스로 사용되며, 불순물을 제거하고 철강 품질을 향상시키는 데 도움이 됩니다.
- 수처리: 불순물을 제거하고 물의 pH를 조정하기 위해 수처리에 사용됩니다.
- 농업: 농업에서 토양 pH를 조절하고 식물에 필수 영양소를 제공하기 위한 토양 개량제로 사용됩니다.
- 화학 산업: 탄화칼슘, 차아염소산칼슘, 스테아르산칼슘과 같은 화학물질 생산에 사용됩니다.
- 건설: 건설 산업에서 시멘트, 모르타르 및 석고의 구성 요소로 사용됩니다.
- 식품 산업: 식품 산업에서 경화제 및 산도 조절제로 사용됩니다.
- 제지 산업: 제지 산업에서 크라프트 펄프화 공정에 사용되는 백액의 성분으로 사용됩니다.
- 석유 산업: 석유 산업에서 정제 공정의 촉매제로 사용됩니다.
질문:
Q: 산화칼슘의 공식은 무엇입니까?
A: 산화칼슘의 공식은 CaO입니다.
Q: 칼슘의 산화수는 얼마입니까?
답: 산화칼슘의 칼슘 산화수는 +2입니다.
Q: 산화칼슘은 이온성입니까, 공유성입니까?
A: 산화칼슘은 양전하를 띤 칼슘 이온과 음전하를 띤 산화물 이온으로 구성된 이온 화합물입니다.
Q: 산화칼슘은 고체인가요?
A: 예, 산화칼슘은 표준 실온 및 압력에서 고체입니다. 흰색 또는 회백색 외관을 가지며 반응성이 매우 높습니다.
