황산구리는 공식 CuSO4를 갖는 청색 결정질 고체입니다. 이는 일반적으로 농업, 살균제, 염료 및 안료 생산에 사용됩니다.
| IUPAC 이름 | 구리(II) 황산염 |
| 분자식 | CuSO4 |
| CAS 번호 | 7758-98-7 |
| 동의어 | 청색 황산구리, 황산구리, 황산구리(2+)염, 황산구리(II), 황산구리, 블루스톤 |
| 인치 | InChI=1S/Cu·H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
몰 질량 of Copper Sulfate
황산구리의 몰 질량은 무수 형태(CuSO4)의 경우 159,609g/mol이고 5수화물 형태(CuSO4·5H2O)의 경우 249,685g/mol입니다. 몰 질량은 분자를 구성하는 모든 원자의 원자 질량의 합입니다. 황산동의 몰 질량은 무수 형태의 구리(Cu) 원자 1개, 황(S) 원자 1개 및 산소(O) 원자 4개의 원자 질량을 더하거나, 무수 형태의 몰 질량에 5수화물 형태의 물 분자 5개(H2O)의 몰 질량입니다.
황산동의 끓는점
황산동은 끓는점에 도달하기 전에 분해되기 때문에 특정한 끓는점을 갖지 않습니다. 그러나 5수화물 형태의 황산구리는 가열되면 물 분자를 잃어 무수 황산구리가 되며 약 650°C에서 분해됩니다. 황산구리의 분해는 흡열 과정으로 열을 흡수합니다.
황산동의 녹는 점
황산구리의 녹는점은 5수화물 형태의 경우 110°C, 무수물 형태의 경우 650°C입니다. 녹는점은 고체 물질이 액체 상태로 변하는 온도이다. 5수화물 형태의 황산구리는 물 분자의 존재로 인해 무수 형태보다 낮은 온도에서 녹으며, 이는 구리, 황 및 산소 원자 사이의 이온 결합을 파괴할 수 있습니다.
황산구리의 밀도 g/ml
황산구리의 밀도는 무수물 형태의 경우 3.6g/mL, 5수화물 형태의 경우 2.284g/mL입니다. 밀도는 단위 부피당 질량을 측정한 것입니다. 황산동의 밀도는 구조 내 물 분자 수의 영향을 받습니다. 왜냐하면 5수화물 형태는 무수 형태보다 단위 부피당 더 많은 물 분자를 포함하기 때문입니다.
황산동의 분자량
황산구리의 분자량은 무수물 형태의 경우 159,609g/mol이고 5수화물 형태의 경우 249,685g/mol입니다. 분자량은 분자를 구성하는 모든 원자의 원자량의 합입니다. 황산구리의 분자량은 필요하거나 생산되는 황산구리의 양을 결정하기 위해 화학 반응 및 화학량론 계산에 사용됩니다.
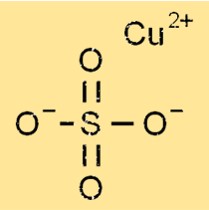
황산구리의 구조
황산구리는 무수물과 5수화물 형태의 팔면체 구조를 가지고 있으며, 여기서 구리 원자 하나는 산소 원자 4개와 황 원자 2개로 둘러싸여 있습니다. 5수화물 형태에서는 5개의 물 분자가 팔면체 구조에 부착되어 수화된 결정 격자를 형성합니다. 구리, 황, 산소 및 물 분자 사이의 이온 결합으로 인해 황산구리의 결정 구조가 형성됩니다.
황산구리 공식
황산동의 공식은 CuSO4로, 이는 구리(Cu) 원자 1개, 황(S) 원자 1개, 산소(O) 원자 4개로 구성되어 있음을 나타냅니다. 이는 일반적으로 황산구리(II) 또는 Blue Vitriol로도 알려져 있습니다. 공식은 분자에 존재하는 각 원소의 원자 수를 나타냅니다.
| 모습 | 청색 결정질 고체 |
| 비중 | 3.6(무수); |
| 색상 | 파란색 |
| 냄새가 나다 | 냄새 없는 |
| 몰 질량 | 159,609g/mol(무수); |
| 밀도 | 3.6g/mL(무수); |
| 융합점 | 110°C(5수화물); |
| 비점 | 끓기 전에 분해됨 |
| 플래시 도트 | 해당 없음 |
| 물에 대한 용해도 | 31.6g/100ml(20°C) |
| 용해도 | 메탄올, 글리세롤에 용해되고, 에탄올에 약간 용해되고, 에테르에는 용해되지 않습니다. |
| 증기압 | 해당 없음 |
| 증기 밀도 | 해당 없음 |
| pKa | 1.99 |
| pH | 3.5 – 4.5 |
황산구리의 안전성과 위험성
황산구리는 적절하게 취급하지 않으면 건강에 위험을 초래할 수 있습니다. 삼키면 유해하며 피부나 눈에 닿으면 자극이나 화상을 입을 수 있습니다. 먼지나 증기를 흡입하면 호흡기 자극이나 손상을 일으킬 수 있습니다. 이는 또한 환경에 대한 잠재적인 위험이며 수생생물에게 유독할 수 있습니다. 황산동을 취급할 때에는 보호복, 장갑, 고글 등을 착용하는 등 예방 조치를 취해야 합니다. 삼켰을 경우, 독극물 관리 센터에 연락하거나 즉시 의사의 진료를 받으십시오. 피부나 눈에 닿은 경우에는 몇 분간 물로 씻어낸 후 의사와 상담하세요.
| 위험 기호 | 시 (짜증난다) |
| 보안 설명 | 피부와 눈에 닿지 않도록 하세요. 보호 장갑과 눈/얼굴 보호구를 착용하십시오. 삼켰을 경우에는 의사와 상담하십시오. |
| AN 식별자 | UN3077(무수물의 경우); UN1512(5수화물용) |
| HS 코드 | 2833.25.00 |
| 위험 등급 | 9 (기타위험물) |
| 포장그룹 | III |
| 독성 | 삼키면 해로울 수 있고, 피부와 눈에 자극을 일으키고, 기도 자극을 일으킬 수 있습니다. |
황산구리 합성 방법
황산구리를 합성하려면 구리를 황산, 산화구리, 수산화구리를 황산과 반응시키는 등 다양한 방법을 사용할 수 있다.
첫 번째 방법으로 황산구리를 합성하려면 황산이 담긴 반응용기에 구리를 넣고 열을 가해 반응을 시작한다. 구리는 황산과 반응하여 황산구리와 물을 생성합니다. 그 후, 생성된 혼합물을 냉각하고 여과하여 남은 용액으로부터 황산구리 결정을 분리한다.
황산구리를 합성하려면 반응 용기에서 산화구리 또는 수산화구리를 황산과 반응시킬 수 있습니다. 반응 후, 혼합물을 냉각하고 황산구리 결정을 남은 용액에서 여과한다.
또 다른 방법은 반응 용기에서 구리를 이산화황 및 산소와 반응시키는 것입니다. 반응을 통해 황산구리와 물이 생성됩니다. 생성된 혼합물을 냉각하고 여과하여 황산구리 결정을 얻는다.
황산구리를 생산하려면 전기분해법을 사용할 수 있다. 이 과정에서 황산구리 수용액이 전기분해되면서 양극에 황산구리가 석출된다. 그런 다음 황산구리 결정을 용액에서 분리하고 건조합니다.
황산구리의 용도
황산구리의 일반적인 용도는 다음과 같습니다.
- 식물 성장에 필수적인 구리를 토양에 제공하기 위해 비료로 사용됩니다. 작물의 곰팡이 질병을 방제하기 위해 살충제로 사용됩니다.
- 동물의 성장과 발달에 필요한 구리 공급원으로 동물 사료에 첨가됩니다.
산업
- 전기 도금에 사용되어 다른 금속 표면에 구리를 증착하여 내식성을 향상시킵니다.
- 물에서 조류 및 기타 불순물을 제거하기 위해 조류 제거제 및 응집제로 수처리에 사용됩니다.
- 분석화학에서 환원당과 단백질 측정을 위한 시약으로 사용됩니다.
- 직물 산업에서 직물에 염료를 고착시켜 더욱 선명한 색상을 부여하는 매염제로 사용됩니다.
- 제약 산업에서 영양 보충제 및 약물용 구리 공급원으로 사용됩니다.
- 또한 안료, 잉크, 페인트 생산뿐만 아니라 배터리, 촉매제, 목재 방부제 제조에도 사용됩니다.
질문:
Q: 황산구리는 물에 용해되나요?
A: 네, 황산동은 물에 잘 녹습니다. 실온에서는 물 100밀리리터당 최대 203그램까지 물에 용해될 수 있습니다.
Q: 가까운 황산구리를 어디에서 구입할 수 있나요?
답변: 황산구리는 대부분의 철물점, 정원 센터, 온라인 소매점에서 쉽게 구입할 수 있습니다. 황산구리는 농업 및 동물 사료에 일반적으로 사용되므로 지역 농자재 판매점이나 사료 판매점에 문의하실 수도 있습니다.
질문: 물 1갤런당 황산구리의 양은 얼마입니까?
답변: 물 1갤런당 필요한 황산구리의 양은 특정 용도에 따라 다릅니다. 예를 들어, 농업 분야에서 권장되는 적용 비율은 일반적으로 에이커당 1~10파운드입니다. 수처리에서 권장되는 복용량은 일반적으로 물 1리터당 0.2~1.0mg입니다. 올바른 사용을 보장하려면 황산구리 제품 라벨의 지침을 주의 깊게 따르는 것이 중요합니다.
Q: 황산구리(ii)의 공식은 무엇입니까?
A: 황산구리(II)의 공식은 CuSO4입니다.
