에탄올 또는 C2H6O는 식물 재료에서 추출한 무색의 가연성 알코올로, 종종 바이오 연료나 용매로 사용됩니다. 또한 알코올 음료의 일반적인 성분이기도 합니다.
| IUPAC 이름 | 에탄올 |
| 분자식 | C2H6O |
| CAS 번호 | 64-17-5 |
| 동의어 | 에틸알코올, 곡물알코올, EtOH, 알코올 |
| 인치 | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
에탄올의 성질
루이스 구조 C2H6O
C2H6O(에탄올이라고도 함)의 루이스 구조는 다음과 같이 그려질 수 있습니다.
허
| |
HCCOH
| |
허
이 구조에서는 두 개의 탄소 원자가 단일 공유 결합으로 서로 연결되어 있습니다. 각 탄소 원자는 세 개의 수소 원자와 결합되고, 하나의 탄소 원자는 하나의 산소 원자와 결합됩니다. 산소 원자는 단일 공유 결합으로 탄소 원자에 연결되어 있으며 두 쌍의 자유 전자를 가지고 있습니다.
이 구조는 분자의 각 원자가 원자가 껍질에 8개의 전자를 가져야 한다는 옥텟 규칙을 충족합니다. 탄소 원자는 원자가 껍질에 4개의 전자를 가지고 있는 반면, 수소 원자는 각각 1개의 전자를 가지고 있습니다. 산소 원자는 6개의 원자가 전자를 갖고 있으며, 2개의 추가 고립전자쌍을 갖고 있어 옥텟 규칙을 만족합니다.
C2H6O 몰 질량
에탄올의 몰질량은 약 46.07g/mol입니다. 물질의 몰 질량은 해당 물질 1몰의 질량으로 정의됩니다. 에탄올의 경우, 에탄올 1몰에는 약 46.07g의 물질이 포함되어 있습니다. 몰 질량은 물질의 질량과 몰 사이의 변환을 허용하기 때문에 화학 계산에서 유용한 매개변수입니다.
에탄올의 끓는점
에탄올의 끓는점은 표준 압력에서 약 78.5°C(173.3°F)입니다. 상대적으로 낮은 끓는점은 많은 산업 공정에서 유용한 에탄올의 증발을 촉진합니다. 예를 들어, 에탄올은 일반적으로 의약품, 향수 및 기타 화학 물질 생산에서 용매로 사용됩니다.
에탄올의 녹는점
에탄올의 녹는점은 약 -114.1°C(-173.4°F)입니다. 이러한 낮은 녹는점으로 인해 에탄올은 실온에서 액체가 되므로 일반적으로 액체 형태의 용매나 연료로 사용됩니다. 에탄올의 녹는점은 물의 녹는점보다 낮기 때문에 에탄올은 자동차 냉각 시스템의 부동액으로 사용될 수 있습니다.
에탄올 밀도 g/mL
에탄올의 밀도는 표준 온도 및 압력에서 약 0.789g/mL입니다. 이는 에탄올 1밀리리터의 무게가 0.789그램임을 의미합니다. 에탄올의 밀도는 표준 온도와 압력에서 밀도가 1g/mL인 물보다 낮습니다. 이는 에탄올이 물 표면에 뜨는 것을 의미합니다.
에탄올 분자량
에탄올의 분자량은 약 46.07g/mol입니다. 분자량은 분자를 구성하는 모든 원자의 원자량의 합입니다. 에탄올의 경우 탄소 원자 2개, 수소 원자 6개, 산소 원자 1개가 포함되어 있습니다. 분자량은 주어진 물질 질량에서 물질의 몰수를 계산하는 데 사용됩니다.
에탄올의 구조
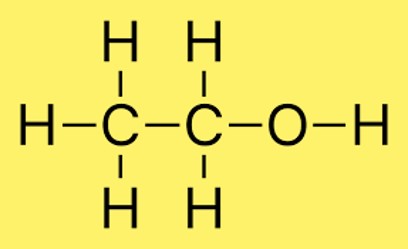
에탄올의 구조에서 두 개의 탄소 원자는 단일 결합을 통해 결합되고 세 개의 수소 원자는 각 탄소 원자에 결합됩니다. 또한, 수소 원자가 산소 원자에 결합되어 있습니다. 분자 내의 원자 배열은 일반적으로 CH3CH2OH로 표시됩니다.
에탄올 공식
에탄올의 화학식은 C2H6O입니다. 이 공식은 분자의 원자 수와 유형을 보여줍니다. 이 공식을 사용하여 에탄올의 분자량과 특정 물질 질량당 에탄올의 몰수를 계산할 수 있습니다. 이 공식은 다른 화학물질과의 반응에서 에탄올의 화학적 거동을 예측하는 데에도 유용합니다.
| 모습 | 무색 액체 |
| 비중 | 0.789 |
| 색상 | 무색 |
| 냄새가 나다 | 특유의 냄새 |
| 몰 질량 | 46.07g/몰 |
| 밀도 | 0.789g/ml |
| 융합점 | -114.1°C(-173.4°F) |
| 비점 | 표준 압력에서 78.5°C(173.3°F) |
| 플래시 도트 | 13°C(55°F) |
| 물에 대한 용해도 | 혼용 가능 |
| 용해도 | 극성 및 비극성 용매에 용해됨 |
| 증기압 | 20°C에서 44.6kPa |
| 증기 밀도 | 1.59(공기=1) |
| pKa | 15.9~25°C |
| pH | 7(중립) |
에탄올의 안전과 위험
에탄올은 가연성 액체이므로 적절하게 취급하지 않을 경우 화재 및 폭발 위험을 초래할 수 있습니다. 에탄올 증기는 쉽게 발화하여 심각한 화재 위험을 초래할 수도 있습니다. 에탄올은 섭취하면 해로울 수 있으며, 과도하게 섭취하면 알코올 중독으로 이어질 수 있습니다. 다량의 에탄올 증기를 흡입하면 현기증, 두통, 메스꺼움을 유발할 수 있습니다. 에탄올에 장기간 노출되면 피부 자극과 건조를 유발할 수도 있습니다. 에탄올은 발화원 및 혼합 금지 물질로부터 멀리 떨어진 서늘하고 통풍이 잘 되는 곳에 보관해야 합니다. 에탄올을 취급할 때는 장갑, 보안경 등 적절한 보호 장비를 사용해야 합니다.
| 위험 기호 | F, 사이, Flam. 액체. 2 |
| 보안 설명 | 열, 스파크, 화염 및 뜨거운 표면으로부터 멀리 보관하십시오. 금연. 방폭형 전기, 환기 및 조명 장비를 사용하십시오. 증기를 흡입하지 마십시오. 보호 장갑, 보호 안경을 착용하십시오. 화재 발생 시: 소화를 위해 건조 화학 분말, CO2, 물 분무 또는 포말을 사용하십시오. 현지/지역/국가/국제 규정에 따라 내용물/용기를 폐기하십시오. |
| AN 식별자 | UN1170 |
| HS 코드 | 2207.10.00 |
| 위험등급 | 삼 |
| 포장그룹 | II |
| 독성 | 에탄올은 다량으로 섭취하거나 흡입할 경우 독성이 있을 수 있습니다. 장기간 노출되면 피부가 자극을 받고 건조해질 수도 있습니다. 만성적으로 섭취하면 알코올 중독 및 기타 건강 문제가 발생할 수 있습니다. |
에탄올 합성 방법
에탄올은 발효, 직접 에틸렌 수화, 바이오매스 전환 등 다양한 방법으로 합성할 수 있습니다.
발효는 에탄올을 생산하는 가장 일반적인 방법이며 효모와 같은 미생물에 의해 설탕과 기타 탄수화물이 에탄올로 전환되는 과정을 포함합니다. 이 공정은 옥수수, 보리, 사탕수수 등의 작물뿐만 아니라 음식물 쓰레기, 농업 잔재물 등의 폐기물로부터 에탄올을 생산하는 데 사용됩니다.
에틸렌의 직접 수화는 에탄올을 생산하는 또 다른 방법입니다. 이 공정에서 에틸렌은 인산 과 같은 촉매 존재 하에서 물과 반응하여 에탄올을 형성합니다. 이 방법은 산업 환경에서 일반적으로 사용되며 발효보다 더 효율적입니다.
바이오매스 전환은 에탄올을 생산하는 또 다른 방법으로, 나무 조각, 풀, 농업 잔여물과 같은 식물 재료를 에탄올로 전환하는 과정을 포함합니다. 이 과정에는 식물 재료의 셀룰로오스와 헤미셀룰로오스를 에탄올로 발효될 수 있는 단당으로 분해하는 과정이 포함됩니다.
에탄올을 생산하는 다른 방법으로는 촉매적 이산화탄소 전환과 전기화학적 이산화탄소 환원이 있습니다.
이러한 각 방법에는 장점과 단점이 있으며, 방법 선택은 원자재 가용성, 비용 및 효율성과 같은 요소에 따라 달라집니다. 발효는 비용 효율성과 신뢰성으로 인해 여전히 가장 널리 사용되는 에탄올 생산 방법입니다.
에탄올의 용도
에탄올은 산업용, 상업용, 개인 용도로 광범위하게 사용됩니다. 일반적인 용도 중 일부는 다음과 같습니다.
- 에탄올은 휘발유 첨가제로 사용될 때 옥탄가를 높이고 배출량을 줄입니다.
- 에탄올은 의약품, 화장품, 개인 위생용품 생산에 일반적으로 사용되는 다용도 용매입니다.
- 맥주, 와인, 증류주와 같은 알코올 음료에는 에탄올이 활성 성분으로 포함되어 있습니다.
- 손 소독제, 표면 세척제 및 기타 청소 제품은 에탄올을 효과적인 소독제로 사용합니다.
- 에탄올은 에센셜 오일, 향료 및 기타 천연 화합물을 추출할 때 용매로 사용됩니다.
- 생산자들은 아세트산, 에틸렌과 같은 다른 화학물질 생산을 위한 공급원료로 에탄올을 사용합니다.
- 향수, 로션, 헤어 케어 제품과 같은 개인 위생 제품은 에탄올을 방부제 및 향료 성분으로 사용합니다.
- 화학 실험실에서는 일반적으로 에탄올을 용매 및 시약으로 사용합니다.
- 자동차 및 기타 냉각 시스템에서는 에탄올을 부동액으로 사용할 수 있습니다.
질문:
에탄올(C2H6O) 분자는 몇 개의 원자로 구성됩니까?
에탄올 분자(C2H6O)는 탄소 원자 2개, 수소 원자 6개, 산소 원자 1개 등 9개의 원자로 구성됩니다.
