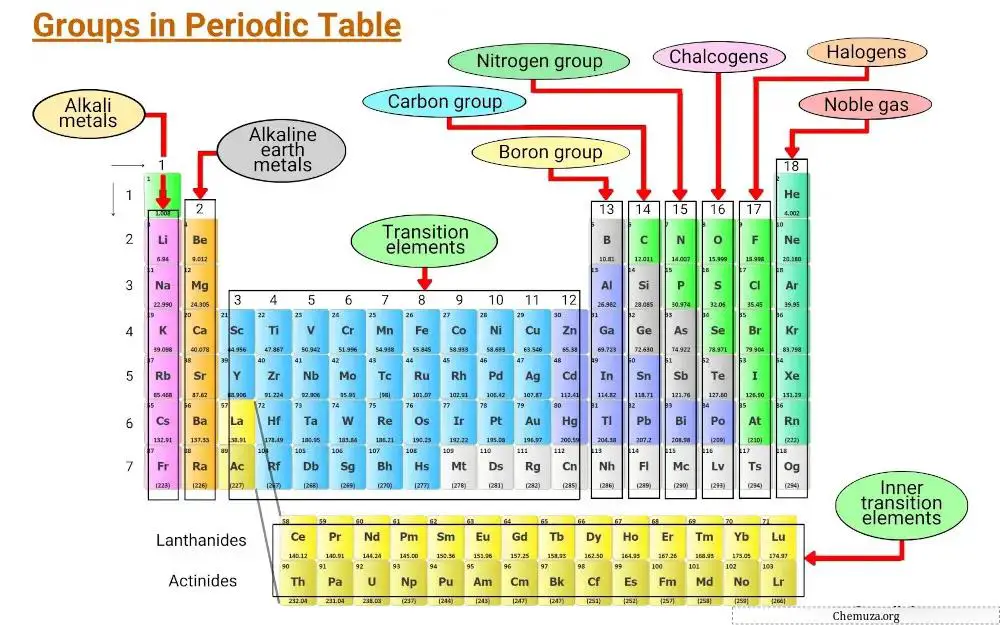
요소는 전자 구성 및 원자가 전자의 동작을 포함한 공통 특성을 기반으로 그룹화됩니다.
주기율표의 수직 열을 족이라고 하며, 주기율표에는 18개의 족이 있으며 각 족은 원소가 다른 원소와 상호 작용하고 화합물을 형성하는 방법을 결정하는 고유한 특성 세트를 가지고 있습니다.
이번 글에서는 주기율표의 다양한 족에 대해 알아보겠습니다.
바로 알아보겠습니다!.
그룹 1: 알칼리 금속
이 그룹에는 리튬, 나트륨, 칼륨, 루비듐, 세슘 및 프란슘이 포함됩니다.
알칼리 금속은 부드러움, 낮은 융점, 물 및 공기와의 높은 반응성으로 잘 알려져 있습니다.
알칼리 금속은 가장 바깥 껍질에 단 하나의 전자만 가지고 있어 쉽게 포기하여 양이온을 형성하기 때문에 반응성이 매우 높습니다. [1]
이로 인해 우수한 전기 전도체로 사용되며 배터리 및 산업 공정을 포함한 다양한 응용 분야에 유용합니다.
그러나 알칼리 금속은 반응성이 높기 때문에 취급 시 주의가 필요합니다. 공기 중에서 자연 발화할 수 있으며 물과 폭발적으로 반응하여 수소 가스를 방출할 수 있습니다. [2]
그룹 2: 알칼리 토금속
주기율표의 2족은 ” 알칼리 토금속 “으로 알려져 있습니다. 이 그룹에는 베릴륨, 마그네슘, 칼슘, 스트론튬, 바륨 및 라듐의 6가지 원소가 포함됩니다.
이러한 금속은 물과 반응하여 알칼리성(염기성) 용액을 형성하기 때문에 “알칼리성”이라고 불립니다.
알칼리 토금속은 높은 녹는점과 끓는점, 낮은 밀도, +2 전하로 쉽게 이온을 형성하는 능력 등 유사한 특성을 가지고 있습니다.
또한 특히 물과 산소에 대해 반응성이 매우 높습니다. 그러나 1족 알칼리 금속과 달리 반응성이 낮고 녹는점이 더 높습니다.
이러한 원소는 뼈(칼슘), 불꽃놀이(스트론튬), 비행기 부품(마그네슘) 등 많은 일상용품에서 발견됩니다.
알칼리 토금속은 알루미늄 및 강철 생산과 같은 산업 공정에도 사용됩니다.
그룹 3 – 11: 전이금속
주기율표의 3~11족을 전이금속 족이라고 합니다. 이 금속은 테이블 위의 다른 품목과 구별되는 독특한 특성을 가지고 있습니다.
전이금속의 특징 중 하나는 유색 화합물을 형성하는 능력입니다.
이는 특정 파장의 빛을 흡수하고 반사할 수 있는 독특한 전자 구성 때문입니다. [삼]
전이금속은 녹는점과 끓는점이 높고 강도와 내구성도 높은 것으로 알려져 있습니다.
건축 자재, 전기 배선, 심지어 보석에도 자주 사용됩니다.
그룹 13: 붕소 그룹
주기율표의 13족은 붕소족으로 알려져 있으며 붕소(B), 알루미늄(Al), 갈륨(Ga), 인듐(In), 탈륨(Tl) 및 니호늄(Nh) 원소를 포함합니다.
이러한 요소는 화학적으로 유사하게 만드는 특정 특성을 공유합니다.
붕소는 이 그룹의 유일한 준 금속 이며, 이는 금속 특성과 비금속 특성을 모두 가지고 있음을 의미합니다.
그룹 14: 탄소 그룹
주기율표의 14족은 탄소족으로 알려져 있으며 탄소(C), 규소(Si), 게르마늄(Ge), 주석(Sn), 납(Pb) 및 플레로븀(Fl)을 포함합니다.
이들 원소는 모두 4개의 원자가 전자를 갖고 있기 때문에 비슷한 성질을 가지고 있습니다.
탄소는 단백질, DNA와 같은 생명의 구성 요소를 포함하여 모든 유기 분자의 기초를 형성하기 때문에 매우 중요한 요소입니다. [4]
그룹 15: 프닉토젠
주기율표의 15족은 질소기(또는 닉토겐)로도 알려져 있습니다.
이 그룹에는 질소(N), 인(P), 비소(As), 안티몬(Sb), 비스무스(Bi) 및 모스코비움(Mc)의 6가지 원소가 포함되어 있습니다.
15족 원소는 가장 바깥쪽 전자 껍질에 5개의 원자가 전자를 가지고 있습니다. 즉, 옥텟을 완성하기 위해 3개의 공유 결합을 형성하는 경향이 있습니다.
그들은 또한 음이온을 형성하기 위해 3개의 전자를 얻는 경향이 있습니다. 그룹 내 요소는 비금속성이 줄어들고 금속성이 높아집니다.
그룹 16: 칼코겐
주기율표의 16족을 산소족이라고 합니다. 여기에는 산소(O), 황(S), 셀레늄(Se), 텔루르(Te), 폴로늄(Po) 및 간(Lv) 원소가 포함됩니다.
이들 원소는 가장 바깥쪽 에너지 준위에 6개의 원자가 전자를 갖는 것을 포함하여 특정 특성을 공유합니다.
산소는 이 그룹의 가장 풍부한 원소이며 물과 많은 유기 분자의 핵심 구성 요소이기 때문에 생명에 필수적입니다.
산소 그룹의 원소는 금속 및 비금속을 포함한 다른 많은 원소와 화합물을 형성할 수 있습니다.
그룹 17: 할로겐
주기율표의 17족은 할로겐족 이라고도 알려져 있습니다. 불소, 염소, 브롬, 요오드, 아스타틴, 테네신의 6가지 원소로 구성되어 있습니다.
모든 할로겐은 원자가 껍질이라고도 알려진 가장 바깥 껍질에 7개의 전자를 가지고 있습니다. 외부 껍질을 완성하고 안정되기 위해서는 하나의 추가 전자만 필요하기 때문에 반응성이 매우 높습니다.
할로겐의 또 다른 중요한 특징은 모두 비금속이라는 것입니다. 즉, 할로겐은 전기를 전도하지 않으며 금속처럼 가단성이나 연성이 없습니다.
또한 실온에서 세 가지 물질 상태로 존재합니다. 불소와 염소는 기체, 브롬은 액체, 요오드와 아스타틴은 고체입니다.
그룹 18: 희가스
희가스에는 헬륨(He), 네온(Ne), 아르곤(Ar), 크립톤(Kr), 크세논(Xe) 및 라돈(Rn)이 포함됩니다.
이러한 가스는 매우 안정적이고 다른 원소와 쉽게 반응하지 않기 때문에 고귀한 가스라고 불립니다.
희가스(noble gas)는 주기율표의 가장 오른쪽 열에 위치하며 모두 전자 껍질이 완전히 외부에 있어 반응성이 매우 낮습니다.
또한 무취, 무색이며 끓는점과 녹는점이 낮습니다.
