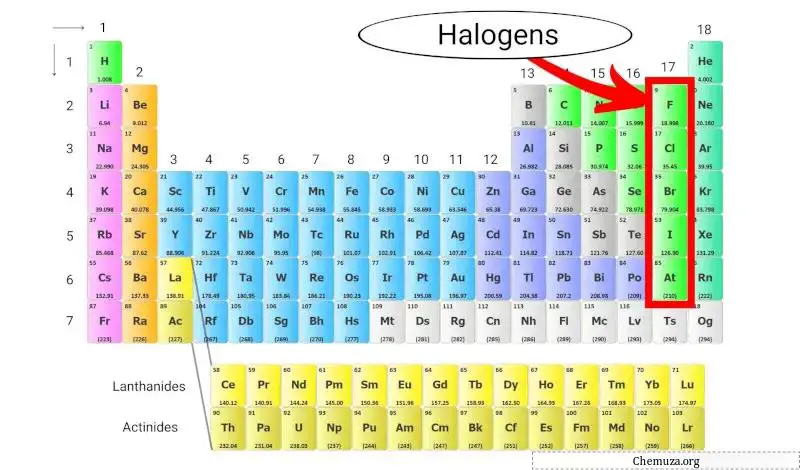
할로겐은 주기율표 17족 (할로겐족이라고도 함)에 있는 원소 그룹입니다. 할로겐에는 불소 (F), 염소 (Cl), 브롬 (Br), 요오드 (I) 및 아스타틴 (At)의 다섯 가지 원소가 포함됩니다.
할로겐은 주기율표의 다른 모든 원소와 화합물을 형성할 수 있는 유일한 원소 그룹이기 때문에 독특합니다.
할로겐에 대해 더 자세히 살펴보겠습니다.
할로겐이란 무엇입니까? 그리고 왜 그렇게 부르나요?
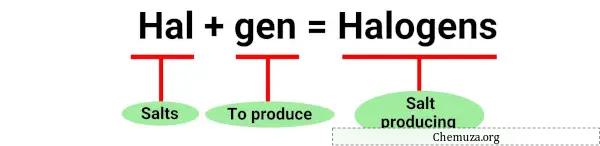
할로겐(halogen)이라는 용어는 소금을 의미하는 그리스어 “halos”와 생산자를 의미하는 “genes”에서 유래되었습니다. [1]
실제로 할로겐은 금속 과 반응할 때 염을 생성하는 능력을 통해 처음 발견되었습니다.
예를 들어:
염소(Cl 2 )가 나트륨 (Na)과 반응하면 일반적인 식탁용 소금인 염화나트륨(NaCl)이 형성됩니다.
2Na + Cl2 → 2NaCl
마찬가지로, 브롬(Br 2 )이 칼륨(K)과 반응하면 브롬화칼륨(KBr)이 형성됩니다.
2K + Br2 → 2KBr
이러한 반응은 금속과 반응할 때 염을 생성하는 할로겐의 예이므로 “할로겐”이라는 이름이 붙었습니다.
주기율표에서 반응성이 가장 큰 할로겐
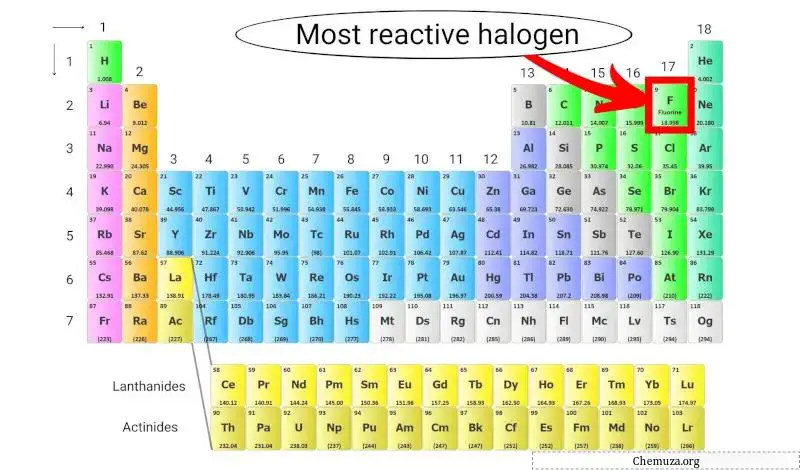
불소는 주기율표의 모든 원소 중 전기 음성도가 가장 높기 때문에 반응성이 가장 큰 할로겐입니다. 즉, 전자에 대한 강한 인력을 갖습니다.
이로 인해 반응성이 매우 높고 주기율표의 거의 모든 다른 원소와 반응하여 화합물을 형성할 수 있습니다. [2]
간단히 말해서, 불소는 전자를 위한 자석과 같으며 전자를 얻고 외부 껍질을 완성하기 위해 할 수 있는 모든 일을 할 것입니다.
이는 다른 원소와 반응하고 전자를 훔쳐 새로운 화합물을 형성함으로써 이를 수행합니다.
이것이 바로 불소가 반응성이 크고 자연에서 원소 형태로 발견되지 않고 항상 화합물로 존재하는 이유입니다.
반응성이 높기 때문에 불소는 매우 위험하며 사용하기에 안전하지 않을 수 있습니다.
이는 전문 실험실에서 처리되는 경우가 많으며 산업 공정에서 광범위한 화학 물질 및 재료를 생산하는 데 사용됩니다.
할로겐의 반응성
할로겐은 전기 음성도가 높기 때문에 반응성이 매우 높습니다. 즉, 전자를 끌어당기는 능력이 매우 높습니다.
또한 할로겐은 가장 바깥 껍질에 7개의 전자를 가지고 있으며 이를 채우고 비활성 가스 와 같은 안정적인 전자 구성에 도달하려면 1개의 추가 전자만 필요합니다.
예를 들어, 불소에 대한 보어 다이어그램의 가장 바깥 껍질에는 7개의 전자가 있음을 알 수 있습니다.
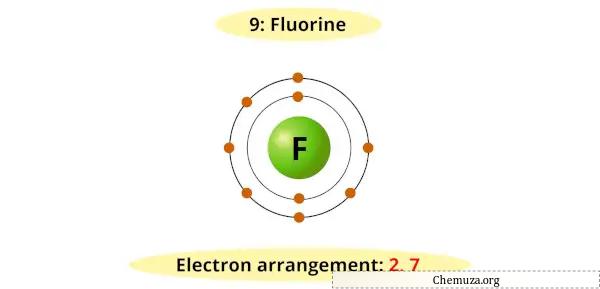
이제 안정적인 옥텟(7 + 1 = 8)을 얻으려면 1개의 추가 전자가 필요합니다.
할로겐은 금속과 반응하여 금속 할로겐화물 이라는 이온 화합물을 형성하며, 이는 밝고 다채로운 불꽃을 생성할 수 있습니다.
또한 수소 , 황 , 질소 와 같은 비금속 과 반응하여 다양한 공유 결합 화합물을 형성합니다. [삼]
따라서 전자를 얻고 안정적인 비활성 기체 구성을 얻으려는 할로겐의 경향은 할로겐을 매우 반응성이 있게 만들고 다른 원소와 화합물을 형성할 수 있게 만듭니다.
주기적인 할로겐 동향
그룹 아래로 이동하면 할로겐 원소는 화학적 특성뿐만 아니라 물리적 특성에도 변화가 나타납니다.
할로겐의 일부 특성의 추세를 살펴보겠습니다.
- 원자 크기: 그룹 아래로 내려갈수록 할로겐의 원자 크기가 증가합니다. 이는 각 할로겐이 그 위의 것보다 에너지 준위가 하나 더 많기 때문입니다. 즉, 가장 바깥쪽 전자가 핵에서 더 멀리 떨어져 있다는 의미입니다.
- 전기 음성도: 그룹 아래로 이동하면 할로겐 원소의 전기 음성도가 감소합니다. 이는 불소 및 염소와 같이 그룹의 맨 위에 있는 할로겐이 전기 음성도가 더 높기 때문에 요오드 및 아스타틴과 같은 맨 아래에 있는 할로겐보다 전자를 끌어당길 가능성이 더 높다는 것을 의미합니다.
- 녹는점과 끓는점: 그룹의 아래로 내려갈수록 할로겐의 녹는점과 끓는점은 증가합니다. 실제로, 더 큰 원자는 더 많은 전자를 가지며 더 강한 분자간 힘을 형성할 수 있습니다. [4]
- 금속에 대한 반응성: 그룹의 아래로 갈수록 금속에 대한 할로겐의 반응성은 감소합니다. 이는 불소 및 염소와 같이 그룹의 맨 위에 있는 할로겐이 요오드 및 아스타틴과 같은 맨 아래에 있는 할로겐보다 금속과 반응할 가능성이 더 높다는 것을 의미합니다.
요약
할로겐은 주기율표 17족에 속하는 5가지 원소(불소, 염소, 브롬, 요오드, 아스타틴)로 이루어진 그룹입니다. 이들은 다른 모든 원소와 화합물을 형성하는 능력이 독특합니다.
할로겐은 전기음성도가 높고 안정적인 비활성 기체 구성을 달성하기 위해 전자를 얻는 경향이 있기 때문에 반응성이 매우 높습니다. 불소는 전기 음성도가 높기 때문에 반응성이 가장 높은 할로겐입니다.
할로겐은 그룹에서 아래로 내려갈수록 원자 크기의 증가, 전기음성도의 감소, 녹는점과 끓는점의 증가와 같은 물리적, 화학적 특성의 변화를 나타냅니다. 금속에 대한 할로겐의 반응성은 그룹 아래로 내려갈수록 감소합니다.
