황산암모늄((NH4)2SO4)은 식물에 필수 영양소를 제공하는 널리 사용되는 비료입니다. 또한 난연제, 단백질 정제 및 식품 첨가물로도 사용됩니다.
| IUPAC의 이름 | 암모늄 테트라옥소설페이트(VI) |
| 분자식 | (NH4)2SO4 |
| CAS 번호 | 7783-20-2 |
| 동의어 | 황산암모늄, 황산암모늄(2:1), 황산이암모늄, 황산이암모늄염, 마스카그나이트, Actamaster, Dolamin |
| 인치 | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
황산암모늄의 성질
황산암모늄 공식
황산암모늄의 공식은 (NH4)2SO4입니다. 이는 황산암모늄 1분자에 2개의 암모늄 이온(NH4)+과 1개의 황산이온(SO4)2-이 포함되어 있음을 의미합니다. 암모늄 이온과 황산염 이온은 이온 결합으로 결합되어 있습니다.
황산암모늄 몰 질량
(NH4)2SO4의 몰 질량은 132.14 g/mol입니다. 몰 질량을 계산하려면 공식에 있는 모든 원자의 원자 질량을 더해야 합니다. 원자 질량은 다음과 같습니다:
- 질소: 14.01g/mol
- 수소: 1.01g/mol
- 황: 32.06g/mol
- 산소: 16.00g/mol
따라서 (NH4)2SO4의 몰 질량은 다음과 같습니다.
(2 x 14.01) + (8 x 1.01) + 32.06 + (4 x 16.00) = 132.14 g/mol
황산암모늄의 끓는점
(NH4)2SO4의 끓는점은 끓는점에 도달하기 전에 분해되기 때문에 잘 정의되지 않습니다. 235°C 이상으로 가열하면 (NH4)2SO4는 물을 잃기 시작하고 중황산암모늄(NH4)HSO4를 형성합니다. 280°C 이상으로 가열하면 중황산암모늄은 암모니아(NH3)와 황산(H2SO4)으로 분해됩니다.
황산암모늄 녹는점
(NH4)2SO4의 녹는점은 235°C입니다. (NH4)2SO4가 고체에서 액체로 변하는 온도입니다. 그러나 위에서 언급한 것처럼 (NH4)2SO4도 이 온도에서 분해되기 시작하므로 순수한 액상은 아니다.
황산암모늄의 밀도 g/ml
(NH4)2SO4의 밀도는 실온 및 압력에서 1.77g/ml입니다. 이는 (NH4)2SO4 1밀리리터의 무게가 1.77그램임을 의미합니다. 물질의 밀도는 온도와 압력에 따라 달라지므로 조건에 따라 조금씩 달라질 수 있습니다.
황산암모늄 분자량
(NH4)2SO4의 분자량은 몰 질량과 동일하며 132.14 g/mol입니다. 분자량은 물질 1몰의 질량으로, 6.022 x 10^23 분자와 같습니다. 분자량은 탄소-12 원자 질량의 1/12에 해당하는 원자 질량 단위(amu)로 표현될 수도 있습니다. amu에서 (NH4)2SO4의 분자량은 132.14 amu입니다.
황산암모늄의 구조
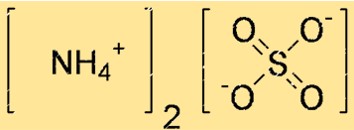
(NH4)2SO4의 구조는 루이스 도트 구조나 볼-스틱 모델로 표현될 수 있습니다. 루이스 도트 구조는 각 원자의 원자가 전자와 원자 사이의 결합을 보여줍니다. 볼-스틱 모델은 각 원자의 모양과 크기, 그리고 원자 사이의 결합을 보여줍니다.
위 구조에서 이중선(=)은 이중결합을, 단일선(-)은 단일결합을, 점(.)은 비공유 전자쌍을 나타냅니다.
황산암모늄의 용해도
(NH4)2SO4의 용해도는 주어진 온도에서 주어진 양의 물에 용해될 수 있는 (NH4)2SO4의 양입니다. (NH4)2SO4의 용해도는 다음 데이터에서 볼 수 있듯이 온도가 증가함에 따라 증가합니다.
| 온도(°C) | 용해도(g/물 100ml) |
| 0 | 70.6 |
| 모습 | 미세한 흰색 흡습성 과립 또는 결정 |
| 비밀도 | 1.77 |
| 색상 | 하얀색 |
| 냄새가 나다 | 냄새 없는 |
| 몰 질량 | 132.14g/몰 |
| 밀도 | 1.77g/cm3 |
| 융합점 | 235~280°C(분해) |
| 비점 | 해당 없음(분해됨) |
| 플래시 도트 | 불연성 |
| 물에 대한 용해도 | 물 100g당 70.6g(0°C), 물 100g당 74.4g(20°C), 물 100g당 103.8g(100°C) |
| 용해도 | 아세톤, 알코올, 에테르에 불용성 |
| 증기압 | 무시할 만한 |
| 증기 밀도 | 해당 없음 |
| pKa | 5.5(암모늄 이온의 경우) |
| pH | 5~6(5% 용액의 경우) |
황산암모늄의 안전성과 위험성
(NH4)2SO4는 인체 건강에 그다지 위험하지 않지만, 접촉하거나 흡입할 경우 피부, 눈, 코, 목에 자극을 일으킬 수 있습니다. 또한 섭취 시 메스꺼움, 복통, 설사, 구토, 졸음을 유발할 수 있습니다. 이는 수생 생물에 유해하므로 환경으로의 방출을 피해야 합니다. 235°C 이상으로 가열하면 분해되어 암모니아, 황산과 같은 독성 가스를 생성합니다. 일반적으로 식품첨가물로서 안전하다고 인식되지만 일부 사람들에게는 알레르기 반응이나 천식 증상을 유발할 수 있습니다.
| 위험 기호 | 필요하지 않음 |
| 보안 설명 | 환경으로의 방출을 피하십시오. 내용물/용기를 승인된 폐기물 처리 시설에 폐기하십시오. |
| UN 식별 번호 | 해당 없음 |
| HS 코드 | 31022100 |
| 위험 등급 | 해당 없음 |
| 포장그룹 | 해당 없음 |
| 독성 | LD50(경구, 쥐) = 2.840mg/kg |
황산암모늄의 합성 방법
(NH4)2SO4는 무기염이기 때문에 다양한 방법으로 합성이 가능합니다. 일반적인 방법 중 일부는 다음과 같습니다.
2NH3 + H2SO4 -> (NH4)2SO4
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- 기타 공정의 부산물: 코크스로 가스 정화, 카프로락탐 생산, 니켈 정제 및 연도 가스 탈황과 같은 다양한 산업 공정에서 (NH4)2SO4가 부산물로 생성될 수 있습니다. 이러한 공정에서는 암모니아 또는 암모늄 화합물을 사용하여 가스 흐름에서 황 또는 기타 불순물을 제거하여 (NH4)2SO4를 폐기물 또는 귀중한 제품으로 생성합니다.
황산암모늄의 용도
(NH4)2SO4는 다음과 같이 다양한 용도로 사용되는 무기염입니다.
- 알칼리성 토양 비료: (NH4)2SO4는 토양 pH를 낮추고 식물 성장을 위해 질소와 황을 제공합니다. 블루베리, 감자, 토마토 등 산성 토양이 필요한 작물에 적합합니다.
- 농업용 살포 보조제: (NH4)2SO4는 작용을 방해할 수 있는 철 및 칼슘 이온을 결합시켜 수용성 살충제, 제초제 및 살균제의 효과를 향상시킵니다. 또한 식물의 글리포세이트 및 기타 전신 제초제의 흡수를 향상시킵니다.
- 단백질 정제: (NH4)2SO4는 이온 강도를 높이고 단백질 용해도를 감소시켜 수용액에서 단백질을 침전시킬 수 있습니다. 염석법은 크기, 전하 및 소수성을 기준으로 단백질을 분리하는 데 사용할 수 있습니다.
- 식품 첨가물: 빵, 치즈, 와인, 야채 통조림과 같은 다양한 식품은 (NH4)2SO4를 산도 조절제, 반죽 조절제, 효모 영양제 및 굳히는제로 사용합니다. FDA는 이를 일반적으로 안전하다고 인정합니다.
- 기타 용도: (NH4)2SO4는 기타 암모늄염, 소화기, 난연제, 가죽 태닝, 직물 염색, 금속 전기도금 및 분석 화학을 만드는 데 사용할 수 있습니다.
질문:
Q: 황산암모늄의 화학식은 무엇입니까?
A: 황산암모늄의 화학식은 (NH4)2SO4입니다. 이는 황산암모늄 1분자에 2개의 암모늄 이온(NH4)+과 1개의 황산이온(SO4)2-이 포함되어 있음을 의미합니다.
Q: 황산암모늄은 용해성이 있나요?
A: (NH4)2SO4는 물에 용해되지만 아세톤, 알코올, 에테르에는 용해되지 않습니다. 0°C에서는 물 100g당 70.6g, 20°C에서는 물 100g당 74.4g, 100°C에서는 물 100g당 103.8g을 녹일 수 있습니다.
질문: 물 1갤런당 황산암모늄의 양은 얼마입니까?
답변: 물 1갤런당 (NH4)2SO4의 양은 원하는 농도와 물의 온도에 따라 다릅니다. 예를 들어 원하는 농도가 10%(w/v)이고 수온이 20°C인 경우 물 1갤런당 (NH4)2SO4의 양은 다음과 같습니다.
10%(w/v) = 물 100ml당 10g 1갤런 = 3785.41ml 10g x 3785.41ml / 100ml = 378.54g 따라서 물 1갤런당 (NH4)2SO4의 양은 378.54g입니다.
Q. 황산암모늄 수용액과 염화칼슘 수용액을 섞으면 반응이 일어나나요?
A: 아니요, (NH4)2SO4 수용액과 염화칼슘을 혼합하면 반응이 일어나지 않습니다. 실제로 두 염은 물에 용해되며 불용성 침전물을 형성하지 않습니다. 생성된 용액에는 암모늄(NH4)+, 황산염(SO4)2-, 칼슘(Ca2+) 및 염화물(Cl)-의 네 가지 이온이 포함되어 있습니다.
Q: 황산암모늄으로 단백질을 침전시키는 방법은 무엇입니까?
A: (NH4)2SO4로 단백질을 침전시키려면 다음 단계를 따라야 합니다.
- 농도와 부피를 알고 있는 (NH4)2SO4 수용액을 준비합니다.
- (NH4)2SO4 용액에 단백질 용액을 천천히 저으면서 첨가합니다.
- 혼합물의 탁도 또는 광학 밀도를 모니터링하여 단백질 침전량을 결정합니다.
- 혼합물을 원심분리하여 단백질 펠렛을 상청액으로부터 분리합니다.
- 상층액을 버리고 단백질 펠릿을 완충액이나 물로 세척하여 과도한 염분을 제거합니다.
- 추가 분석이나 사용을 위해 단백질 펠릿을 적절한 완충액에 다시 중단하거나 용해시킵니다.
Q: 황산암모늄 분자 6.90개에는 몇 그램이 들어있나요?
A: (NH4)2SO4 분자 6.90개가 몇 그램인지 알아내려면 아보가드로 수와 (NH4)2SO4의 몰 질량을 사용해야 합니다. 아보가드로 수는 6.022 x 10^23입니다. 이는 모든 물질 1몰에 그만큼의 분자가 포함되어 있음을 의미합니다. (NH4)2SO4의 몰질량은 132.14g/mol입니다. 이는 (NH4)2SO4 1몰의 무게가 그 만큼임을 의미합니다. 따라서 이 공식을 사용하여 (NH4)2SO4 분자 6.90개에 몇 그램이 있는지 계산할 수 있습니다.
그램 = 분자 x 몰질량 / 아보가드로수 그램 = 6.90 x 132.14 / 6.022 x 10^23 그램 = 1.52 x 10^-21 따라서 (NH4)2SO4 분자 6.90개에는 1.52 x 10^-21 그램이 있습니다.
Q: 황산암모늄에는 황이 얼마나 들어있나요?
A: (NH4)2SO4에는 질량 기준으로 24%의 황이 포함되어 있습니다. 이는 조성 백분율 공식과 황 및 (NH4)2SO4의 몰 질량을 사용하여 계산할 수 있습니다. 황의 몰 질량은 32.06 g/mol이고 (NH4)2SO4의 몰 질량은 132.14 g/mol입니다. 따라서 (NH4)2SO4의 황 함량은 다음과 같습니다.
백분율 = 황의 몰질량 x 100 / 황산암모늄의 몰질량 백분율 = 32.06 x 100 / 132.14 백분율 = 24.26%
Q: 이 소금 중 중성소금은 무엇인가요? na2so4 nacn kf(nh4)2so4
A: 중성염은 물에 용해되었을 때 용액의 pH에 영향을 주지 않는 염입니다. 강산과 강염기가 반응하여 형성됩니다. 주어진 네 가지 염 중에서 na2so4만이 중성염입니다. 수산화나트륨(강염기)과 황산(강산)이 반응하여 생성됩니다. 다른 염은 산성이거나 염기성입니다. Nacn은 수산화나트륨(강염기)과 시안화수소산(약산)의 반응으로 형성된 염기성 염입니다. Kf는 수산화칼륨(강염기)과 불산(약산)의 반응으로 형성된 염기성 염입니다. (Nh4)2so4는 수산화암모늄(약염기)과 황산(강산)의 반응으로 형성된 산성 염입니다.
Q: (nh4)2so4의 몰 질량은 얼마입니까?
A: (nh4)2so4의 몰 질량은 132.14 g/mol입니다. 몰 질량을 찾으려면 공식에 있는 모든 원자의 원자 질량을 더해야 합니다. 원자 질량은 다음과 같습니다:
- 질소: 14.01g/mol
- 수소: 1.01g/mol
- 황: 32.06g/mol
- 산소: 16.00g/mol
따라서 (nh4)2so4의 몰 질량은 다음과 같습니다.
(2 x 14.01) + (8 x 1.01) + 32.06 + (4 x 16.00) = 132.14 g/mol
Q: (nh4)2so4는 물에 용해되나요?
A: 네, (nh4)2so4는 물에 용해됩니다. 0°C에서는 물 100g당 최대 70.6g, 20°C에서는 물 100g당 74.4g, 100°C에서는 물 100g당 103.8g을 녹일 수 있습니다.
