염화티오닐은 다양한 산업 분야에 사용되는 화합물입니다. 알코올 및 카르복실산과 반응하여 각각 상응하는 염화물과 염화설퍼릴을 생성합니다.
| IUPAC의 이름 | 염화티오닐 |
| 분자식 | SOCl2 |
| CAS 번호 | 7719-09-7 |
| 동의어 | 이염화황, 옥시염화황, 이염화티오닐 |
| 인치 | InChI=1S/Cl2OS/c1-4(2)3 |
염화티오닐의 성질
염화티오닐 공식
티오닐디클로라이드의 공식은 SOCl2이며, 이는 두 개의 염소 원자에 결합된 하나의 황 원자를 나타냅니다. 다양한 산업 분야에서 널리 사용되는 화합물입니다.
염화티오닐 몰 질량
티오닐 디클로라이드의 몰질량은 몰당 약 118.97g입니다. 몰 질량은 구성 원소의 원자 질량을 더하여 결정됩니다.
염화티오닐의 끓는점
티오닐디클로라이드의 끓는점은 약 섭씨 79.6도입니다. 이는 이염화티오닐의 액체 형태가 기체 상태로 변하는 온도입니다.
염화티오닐의 녹는점
이염화티오닐의 녹는점은 약 -104.5℃입니다. 이는 이염화티오닐의 고체 형태가 액체 상태로 변하는 온도입니다.
염화티오닐의 밀도 g/mL
티오닐디클로라이드의 밀도는 밀리리터당 약 1.64g입니다. 밀도는 단위 부피당 질량의 척도이며 물질의 중요한 특성입니다.
염화티오닐 분자량
티오닐디클로라이드의 분자량은 몰당 약 118.97g입니다. 황, 염소, 산소의 원자량을 더해 계산됩니다.
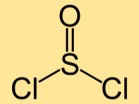
염화티오닐의 구조
티오닐디클로라이드의 구조는 두 개의 염소 원자에 결합된 황 원자로 구성됩니다. 황과 염소 원자는 선형으로 배열되어 곡선 모양의 분자를 형성합니다.
염화티오닐의 용해도
티오닐디클로라이드는 물에 잘 녹지 않지만 벤젠, 톨루엔, 사염화탄소와 같은 유기용매에는 쉽게 용해됩니다. 용해도는 응용 분야에서 중요한 요소입니다.
| 모습 | 무색 내지 담황색의 액체 |
| 비중 | 1,638g/mL |
| 색상 | 무색 |
| 냄새가 나다 | 매운, 질식하는 |
| 몰 질량 | 118.97g/몰 |
| 밀도 | 1,638g/mL |
| 융합점 | -104.5°C |
| 비점 | 79.6°C |
| 플래시 도트 | 해당 없음 |
| 물에 대한 용해도 | 격렬하게 반응함 |
| 용해도 | 벤젠, 톨루엔, 사염화탄소 등의 유기용매에 용해됩니다. |
| 증기압 | 20°C에서 4.33kPa |
| 증기 밀도 | 3.9(공기=1) |
| pKa | -6.3 |
| pH | 해당 없음 |
염화티오닐의 안전성과 위험성
티오닐디클로라이드는 여러 가지 안전 위험을 초래하므로 주의해서 취급해야 합니다. 부식성이 매우 높으며 피부, 눈 또는 점막에 접촉하면 심각한 화상을 입을 수 있습니다. 증기를 흡입하면 자극과 호흡기 손상을 일으킬 수 있습니다. 이 화합물은 물과 격렬하게 반응하여 염화수소와 같은 독성 가스를 방출합니다. 따라서 습기가 많은 곳에서 멀리 떨어진 곳에 보관하고 취급해야 합니다. 또한 티오닐디클로라이드는 알코올 및 수분 함유 화합물과 격렬하게 반응하여 화재나 폭발 위험을 초래할 수 있습니다. 이염화티오닐을 안전하게 취급하려면 적절한 환기, 개인 보호 장비 및 적절한 보관 관행이 필수적입니다.
| 위험 기호 | 부식성(C), 독성(T), 환경에 위험함(N) |
| 보안 설명 | – 습기 및 혼합 금지 물질의 발생원을 피하십시오.<br>- 환기가 잘 되는 곳에서 사용하고, 적절한 개인 보호 장비를 착용하십시오.<br>- 피부, 눈, 점막에 닿지 않도록 주의하여 취급하십시오.<br> – 밀폐용기에 담아 서늘하고 건조한 곳에 보관하세요. |
| UN 식별 번호 | UN 번호 1836(티오닐 디클로라이드) |
| HS 코드 | 2812.10.00 |
| 위험 등급 | 8 (부식성 물질) |
| 포장그룹 | II (다소 위험함) |
| 독성 | 흡입, 섭취, 피부 흡수 시 독성이 매우 높습니다.<br>- 심각한 화상과 호흡기 자극을 일으킬 수 있습니다.<br>- 수생생물에 장기적으로 유해한 영향을 미칠 수 있습니다. |
염화티오닐의 합성 방법
다양한 방법을 통해 티오닐 디클로라이드를 합성할 수 있습니다.
일반적인 접근법은 활성탄이나 염화알루미늄 과 같은 촉매 존재 하에서 삼산화황(SO₃)과 이염화황(SCl2) 사이의 반응을 포함합니다. 반응은 일반적으로 약 300~400°C의 고온에서 일어나서 이염화티오닐이 생성됩니다.
또 다른 방법은 이산화황(SO2)을 오염화인(PCl₅) 또는 옥시염화인(POCl₃)과 직접 반응시키는 것입니다. 이 반응은 시약을 점진적으로 첨가하면서 환류하면서 일어나서 이염화티오닐이 생성됩니다.
황과 삼염화인(PCl₃) 이 반응하면 이염화티오닐이 생성됩니다. 이 공정에는 반응물을 가열하고 이염화티오닐을 형성하는 과정이 포함됩니다.
또 다른 방법은 염화알루미늄과 같은 루이스산 촉매 존재 하에서 오황화인(P₂S₅)과 오염화인(PCl₅) 을 반응시키는 것입니다. 반응은 고온에서 일어나며 티오닐 디클로라이드가 형성됩니다.
이러한 합성 방법에는 관련 시약의 위험 특성으로 인해 적절한 취급 및 안전 예방 조치가 필요하다는 점에 유의하는 것이 중요합니다. 이염화티오닐을 안전하고 효율적으로 합성하려면 숙련된 화학자의 전문 지식과 적절한 실험실 장비의 사용이 필요합니다.
염화티오닐의 용도
티오닐디클로라이드는 다양한 화학적 특성으로 인해 다양한 산업 분야에서 폭넓게 응용됩니다. 다음은 티오닐디클로라이드의 몇 가지 일반적인 용도입니다.
- 카르복실산의 전환: 이염화티오닐은 주로 유기 합성에서 Vilsmeier-Haack 반응을 사용하여 카르복실산을 염화아실로 전환합니다.
- 알코올 염소화: 이염화티오닐은 알코올과 반응하여 염화 알킬을 형성하고 Darzens 반응으로 알려진 의약품 및 농약용 염소화 화합물 생산에 적용됩니다.
- 탈수제: 이염화티오닐은 탈수제 역할을 하여 물에서 다양한 화합물의 제거를 촉진합니다. 이는 일반적으로 염료, 향수 및 제약 중간체의 합성에 사용됩니다.
- 리튬 이온 배터리 제조: 제조업체는 티오닐 디클로라이드를 사용하여 에너지 밀도가 높고 수명이 긴 리튬-이염화 티오닐 배터리를 생산합니다. 이 배터리는 의료 기기, 군사 장비 및 원격 센서에 적용됩니다.
- 중합 반응: 이염화티오닐은 중합 반응에 참여하여 폴리카보네이트 및 폴리무수물을 포함한 다양한 중합체의 합성에 기여합니다.
- 인 화합물: 이염화티오닐은 삼염화인과 같은 인 화합물과 반응하여 염화포스포릴을 생성합니다. 화학자들은 이러한 중간체를 사용하여 유기인산염 화합물과 난연제를 합성합니다.
- 화학 시약: 이염화티오닐은 에스테르화, 할로겐화 및 친핵성 치환 반응을 포함한 많은 화학적 변형에서 다용도 시약으로 사용됩니다.
질문:
Q: 염화티오닐을 무엇으로 헹굴 수 있나요?
A: 티오닐 디클로라이드는 과량의 알코올이나 메탄올이나 중탄산나트륨 용액과 같은 호환 가능한 염기로 헹궈질 수 있습니다.
Q: 발레르산과 염화티오닐의 생성물은 무엇입니까?
A: 발레르산과 이염화티오닐의 반응으로 염화발레릴과 이산화황 가스가 생성됩니다.
Q: 카복실산에 염화티오닐을 첨가할 수 있나요?
A: 예, Vilsmeier-Haack 반응을 통해 카복실산에 티오닐 디클로라이드를 첨가하여 아실 클로라이드로 전환할 수 있습니다.
Q: 다음 중 염화티오닐(SOCl2)에 대한 올바른 루이스 식은 무엇입니까?
A: 티오닐 디클로라이드(SOCl2)에 대한 올바른 루이스 공식은 S=O | Cl – Cl.
Q: 염화티오닐 반응을 일으키는 원인은 무엇입니까?
A: 티오닐 디클로라이드 반응은 다양한 화학적 변형에서 친전자체 역할을 하는 티오닐 클로라이드의 높은 반응성에 의해 추진됩니다.
Q: 염화티오닐을 소화하는 방법은 무엇입니까?
A: 티오닐디클로라이드는 1차 또는 2차 알코올과 같은 적절한 담금질제를 첨가하거나 물로 조심스럽게 가수분해하여 담금질할 수 있습니다.
Q: 아민과 염화티오닐을 혼합하면 무엇을 얻게 됩니까?
A: 아민을 티오닐 디클로라이드와 혼합하면 상응하는 아민 하이드로클로라이드 염이 형성됩니다.
Q: 염화티오닐이란 무엇인가요?
A: 티오닐디클로라이드는 SOCl2라는 화학식을 갖는 화합물로, 일반적으로 유기 합성 시 시약 및 탈수제로 사용됩니다.
Q: 과잉 염화티오닐은 어떤 역할을 합니까?
A: 과도한 티오닐디클로라이드는 격렬한 반응을 일으켜 독성 가스 또는 폭발 위험을 생성할 수 있으므로 주의해서 취급해야 합니다.
Q: 염화티오닐을 중화하는 방법은 무엇입니까?
A: 티오닐디클로라이드는 적절한 안전 예방 조치를 취하면서 중탄산나트륨이나 수산화나트륨과 같은 적절한 염기를 과량으로 첨가하여 중화할 수 있습니다.
