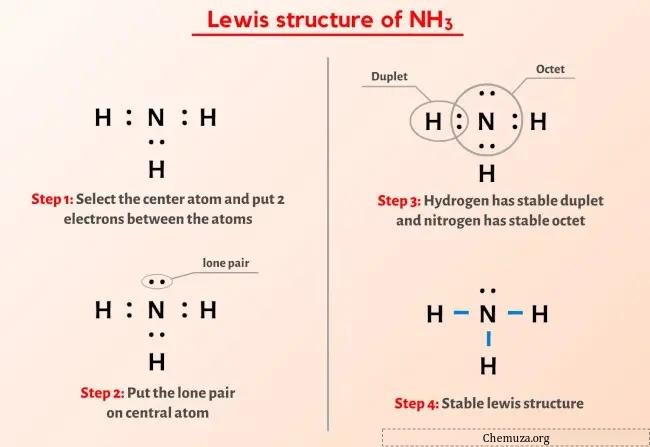
그럼 위 이미지는 이미 보셨죠?
위의 이미지를 간단히 설명하겠습니다.
NH3(암모니아)의 루이스 구조는 중앙에 질소(N) 원자가 3개의 수소(H) 원자로 둘러싸여 있습니다. 질소 원자(N)와 각 수소 원자(H) 사이에는 3개의 단일 결합이 있습니다. 질소(N) 원자에는 1개의 자유 이중선이 있습니다.
NH3의 루이스 구조에 대한 위의 이미지에서 아무것도 이해하지 못했다면 저와 함께 있으면 NH3 의 루이스 구조를 그리는 방법에 대한 자세한 단계별 설명을 얻을 수 있습니다.
이제 NH3의 루이스 구조를 그리는 단계로 넘어가겠습니다.
NH3 루이스 구조를 그리는 단계
1단계: NH3 분자의 총 원자가 전자 수 찾기
NH3 분자 의 총 원자가 전자 수를 찾으려면 먼저 수소 원자 뿐만 아니라 질소 원자에도 존재하는 원자가 전자를 알아야 합니다.
(가전자는 모든 원자의 가장 바깥쪽 궤도 에 존재하는 전자입니다.)
여기에서는 주기율표 를 이용하여 수소뿐만 아니라 질소의 원자가 전자를 쉽게 찾는 방법을 알려 드리겠습니다.
NH3 분자의 총 원자가 전자
→ 질소 원자에 의해 주어진 원자가 전자:
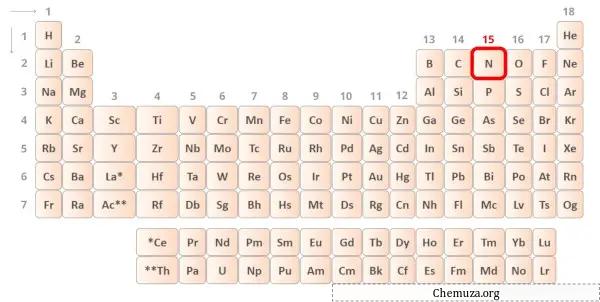
질소는 주기율표 15족에 속하는 원소입니다.[1] 따라서 질소에 존재하는 원자가 전자는 5 입니다.

위 이미지와 같이 질소 원자에 존재하는 5개의 원자가 전자를 볼 수 있습니다.
→ 수소 원자에 의해 주어진 원자가 전자:
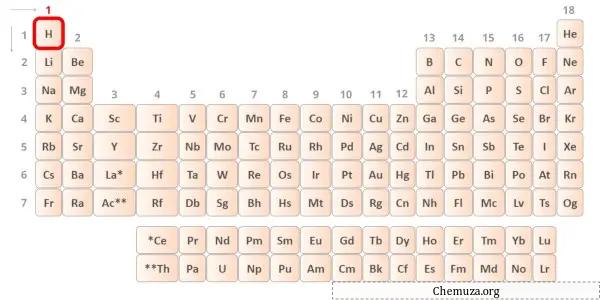
수소는 주기율표의 1족 원소 이다. [2] 따라서 수소에 존재하는 원자가전자는 1 이다.

위 이미지와 같이 수소 원자에는 원자가 전자가 하나만 존재하는 것을 볼 수 있습니다.
그래서,
NH3 분자의 총 원자가 전자 = 1개의 질소 원자가 제공하는 원자가 전자 + 3개의 수소 원자가 제공하는 원자가 전자 = 5 + 1(3) = 8 .
2단계: 중심 원자 선택
중심 원자를 선택하려면 전기 음성도 가 가장 낮은 원자가 중심에 남아 있다는 것을 기억해야 합니다.
(기억하세요: 주어진 분자에 수소가 존재하는 경우 항상 수소를 외부에 배치하십시오.)
이제 여기서 주어진 분자는 NH3(암모니아)이며 질소(N)와 수소(H) 원자를 포함합니다.
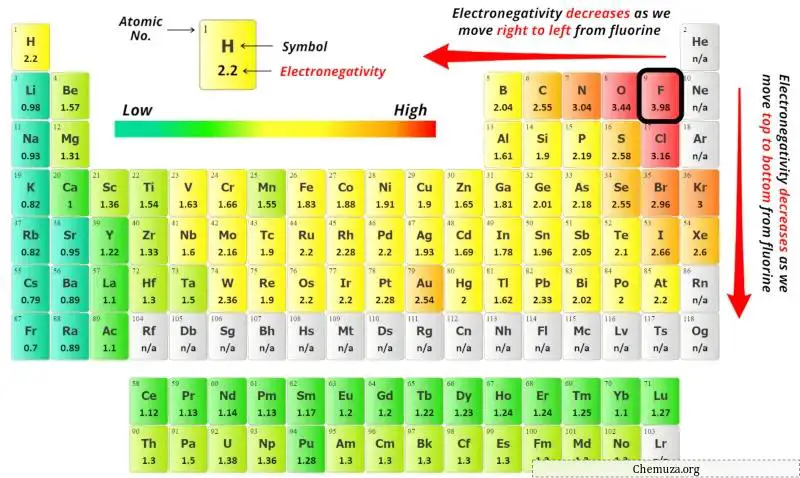
위의 주기율표에서 질소(N) 원자와 수소(H) 원자의 전기음성도 값을 확인할 수 있습니다.
질소(N)와 수소(H)의 전기음성도 값을 비교하면 수소 원자의 전기음성도가 덜합니다 . 하지만 규칙에 따르면 수소는 외부에 보관해야 합니다.
여기서 질소(N) 원자는 중심 원자이고 수소(H) 원자는 외부 원자이다.
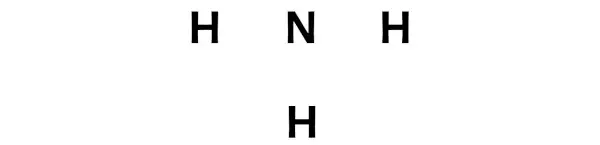
3단계: 각 원자 사이에 전자쌍을 배치하여 각 원자를 연결합니다.
이제 NH3 분자에서는 질소(N) 원자와 수소(H) 원자 사이에 전자쌍을 배치해야 합니다.
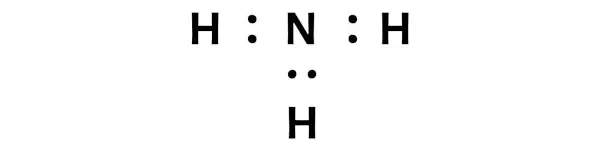
이는 NH3 분자 내에서 질소(N)와 수소(H)가 화학적으로 결합되어 있음을 나타냅니다.
4단계: 외부 원자를 안정하게 만듭니다. 나머지 원자가 전자쌍을 중심 원자에 놓습니다.
이 단계에서는 외부 원자의 안정성을 확인해야 합니다.
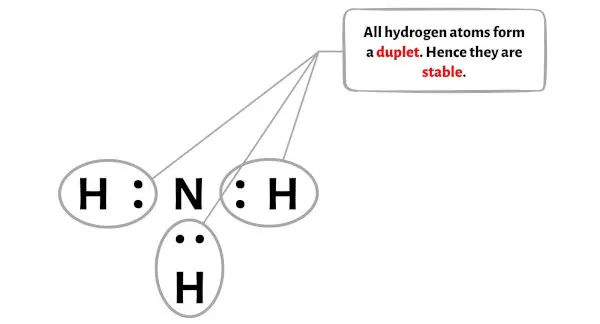
여기 NH3 분자 다이어그램에서 외부 원자가 수소 원자임을 알 수 있습니다.
이러한 외부 수소 원자는 이중체를 형성하므로 안정적입니다.
또한 1단계에서는 NH3 분자에 존재하는 총 원자가 전자 수를 계산했습니다.
NH3 분자에는 총 8개의 원자가 전자가 있으며, 이 중 6개의 원자가 전자 만이 위 다이어그램에 사용되었습니다.
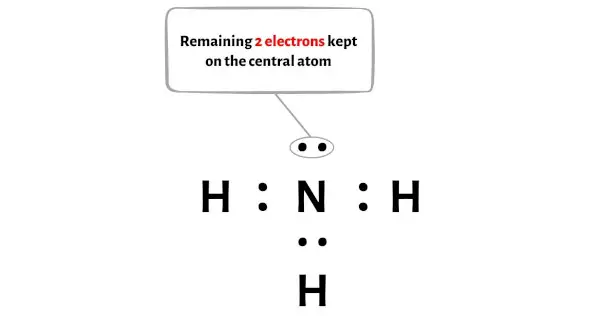
따라서 남은 전자의 수 = 8 – 6 = 2 .
위의 NH3 분자 다이어그램에서 중앙 질소 원자에 이 2개의 전자를 배치해야 합니다.
이제 다음 단계로 넘어가겠습니다.
5단계: 중심 원자의 옥텟 확인
이 단계에서는 중심 질소(N) 원자가 안정적인지 여부를 확인해야 합니다.
중심 질소(N) 원자의 안정성을 확인하려면 옥텟을 형성하는지 여부를 확인해야 한다.
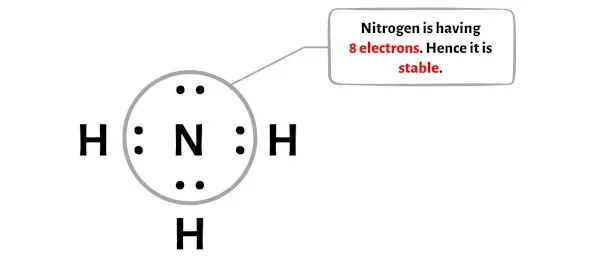
위 이미지에서 질소 원자가 옥텟을 형성하는 것을 볼 수 있습니다. 즉, 전자가 8개 있다는 의미입니다.
그래서 중심 질소 원자는 안정적입니다.
이제 NH3의 루이스 구조가 안정적인지 확인하기 위한 마지막 단계로 넘어가겠습니다.
6단계: 루이스 구조의 안정성 확인
이제 NH3 루이스 구조의 안정성을 확인해야 하는 마지막 단계에 도달했습니다.
루이스 구조의 안정성은 형식 전하 개념을 사용하여 검증할 수 있습니다.
간단히 말해서, 이제 우리는 NH3 분자에 존재하는 수소 원자(H)뿐만 아니라 질소 원자(N)의 형식 전하를 찾아야 합니다.
공식세를 계산하려면 다음 공식을 사용해야 합니다.
형식 전하 = 원자가 전자 – (결합 전자)/2 – 비결합 전자
아래 이미지에서 NH3 분자의 각 원자에 대한 결합 전자 와 비결합 전자 의 수를 확인할 수 있습니다.
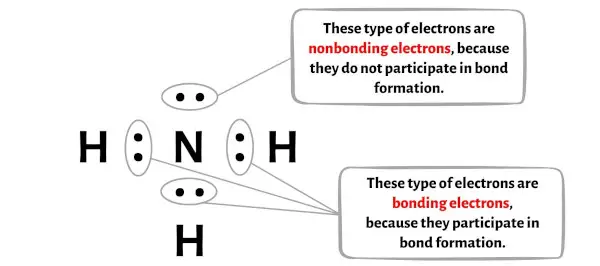
질소 원자(N)의 경우:
원자가 전자 = 5 (질소가 15족에 속하기 때문)
결합 전자 = 6
비결합 전자 = 2
수소 원자(H)의 경우:
원자가 전자 = 1 (수소가 1족에 속하기 때문)
결합 전자 = 2
비결합 전자 = 0
| 공식적인 고발 | = | 원자가 전자 | – | (전자 결합)/2 | – | 비결합 전자 | ||
| 아니다 | = | 5 | – | 6/2 | – | 2 | = | 0 |
| 시간 | = | 1 | – | 2/2 | – | 0 | = | 0 |
위의 형식 전하 계산을 통해 질소(N) 원자 와 수소(H) 원자 모두 “0” 형식 전하를 가짐을 알 수 있습니다.
이는 NH3의 위 루이스 구조가 안정적이고 NH3의 위 구조에 더 이상 변화가 없음을 나타냅니다.
위 NH3의 루이스 도트 구조에서는 각 결합전자쌍(:)을 단일결합(|)으로 나타낼 수도 있습니다. 그렇게 하면 NH3의 루이스 구조가 다음과 같이 됩니다.
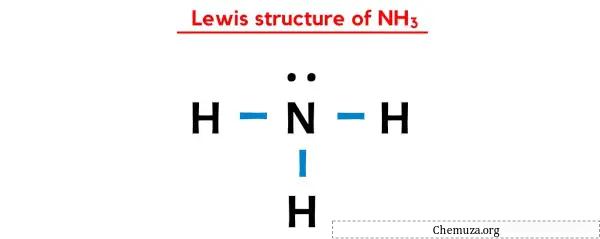
위의 모든 단계를 완전히 이해하셨기를 바랍니다.
더 많은 연습과 더 나은 이해를 위해 아래 나열된 다른 루이스 구조를 시도해 볼 수 있습니다.
더 나은 이해를 위해 다음 루이스 구조를 시도해 보세요(또는 적어도 확인하세요).
