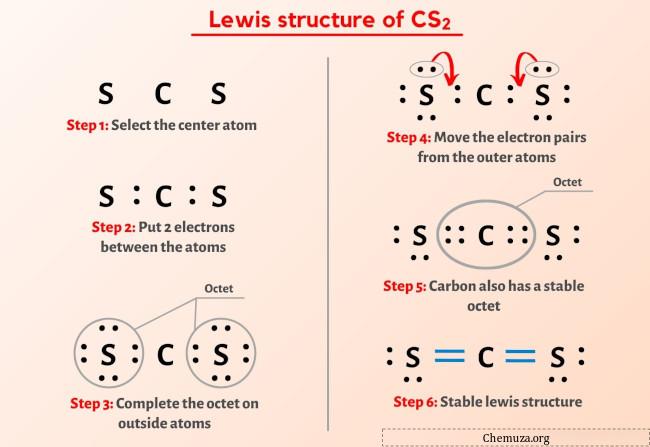
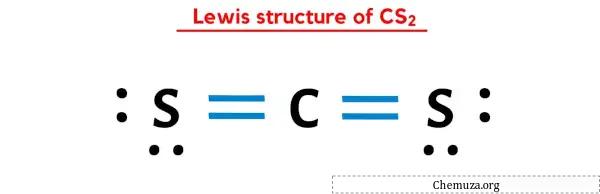
그럼 위 이미지는 이미 보셨죠?
위의 이미지를 간단히 설명하겠습니다.
CS2 루이스 구조는 중앙에 두 개의 황(S) 원자로 둘러싸인 탄소(C) 원자가 있습니다. 탄소 원자(C)와 각 황 원자(S) 사이에는 2개의 이중 결합이 있습니다. 두 개의 황(S) 원자에는 2개의 비공유전자쌍이 있습니다.
위의 CS2 루이스 구조(이황화 탄소) 이미지에서 아무것도 이해하지 못했다면 저와 함께 있으면 CS2 루이스 구조를 그리는 방법에 대한 자세한 단계별 설명을 얻을 수 있습니다.
이제 CS2의 루이스 구조를 그리는 단계로 넘어가겠습니다.
CS2 루이스 구조를 그리는 단계
1단계: CS2 분자의 총 원자가 전자 수 찾기
CS2(이황화탄소) 분자 의 총 원자가 전자 수를 찾으려면 먼저 황 원자뿐만 아니라 탄소 원자 에 존재하는 원자가 전자를 알아야 합니다.
(가전자는 모든 원자의 가장 바깥쪽 궤도 에 존재하는 전자입니다.)
여기에서는 주기율표를 이용하여 탄소와 황의 원자가전자를 쉽게 구하는 방법을 알려드리겠습니다.
CS2 분자의 총 원자가 전자
→ 탄소 원자에 의해 주어진 원자가 전자:
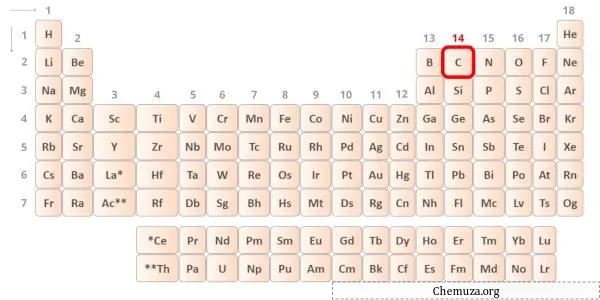
탄소 는 주기율표 14족에 속하는 원소이다. [1] 따라서 탄소에 존재하는 원자가 전자는 4 입니다.
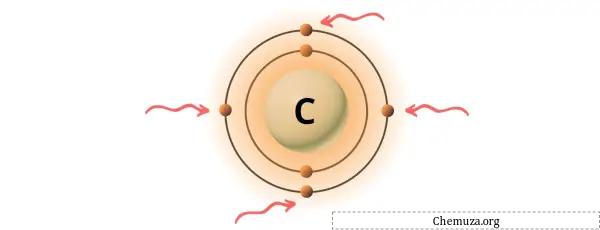
위 이미지와 같이 탄소 원자에 존재하는 4개의 원자가 전자를 볼 수 있습니다.
→ 황 원자에 의해 주어진 원자가 전자:
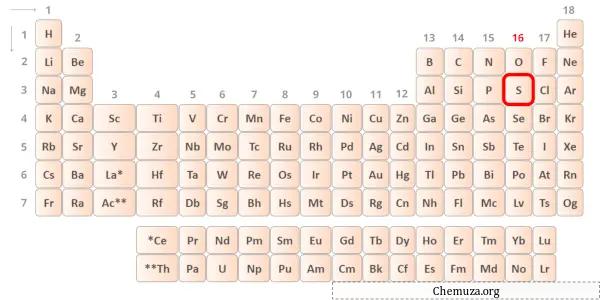
황은 주기율표 16족의 원소이다. [2] 따라서 황에 존재하는 원자가 전자는 6 입니다.
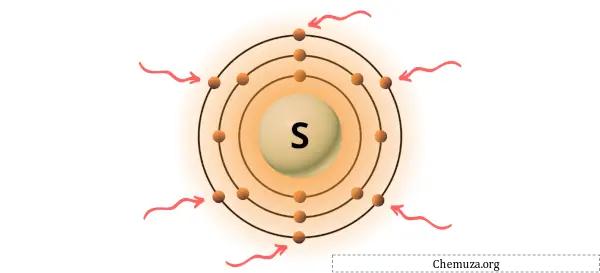
위 이미지와 같이 황 원자에 존재하는 6개의 원자가 전자를 볼 수 있습니다.
그래서,
CS2 분자의 총 원자가 전자 = 1개의 탄소 원자가 제공하는 원자가 전자 + 2개의 황 원자가 제공하는 원자가 전자 = 4 + 6(2) = 16 .
2단계: 중심 원자 선택
중심 원자를 선택하려면 전기 음성도 가 가장 낮은 원자가 중심에 남아 있다는 것을 기억해야 합니다.
이제 여기서 주어진 분자는 CS2(이황화탄소)이며 탄소(C) 원자와 황(S) 원자를 포함합니다.
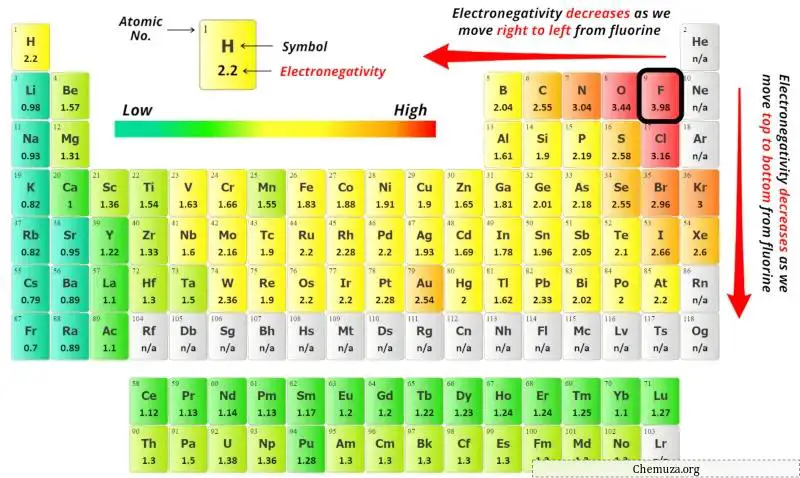
위의 주기율표에서 탄소원자(C)와 황원자(S)의 전기음성도 값을 확인할 수 있습니다.
탄소(C)와 황(S)의 전기음성도 값을 비교하면 탄소 원자의 전기음성도가 덜합니다 .
여기서 탄소(C) 원자는 중심 원자이고 황(S) 원자는 외부 원자이다.
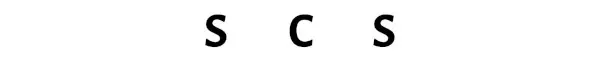
3단계: 각 원자 사이에 전자쌍을 배치하여 각 원자를 연결합니다.
이제 CS2 분자에서 탄소 원자(C)와 황 원자(S) 사이에 전자쌍을 배치해야 합니다.
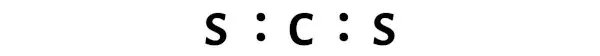
이는 CS2 분자 내에서 탄소(C)와 황(S)이 화학적으로 결합되어 있음을 나타냅니다.
4단계: 외부 원자를 안정적으로 만들기
이 단계에서는 외부 원자의 안정성을 확인해야 합니다.
여기 CS2 분자의 스케치에서 외부 원자가 황 원자임을 알 수 있습니다.
이러한 외부 황 원자는 옥텟을 형성하므로 안정적입니다.

또한 1단계에서는 CS2 분자에 존재하는 총 원자가 전자 수를 계산했습니다.
CS2 분자에는 총 16개의 원자가 전자가 있으며 이러한 모든 원자가 전자는 위의 CS2 다이어그램에 사용됩니다.
따라서 더 이상 중심 원자에 유지될 전자쌍이 없습니다.
그럼 이제 다음 단계로 넘어가겠습니다.
5단계: 중심 원자의 옥텟을 확인합니다. 옥텟이 없으면 고립전자쌍을 이동하여 이중결합이나 삼중결합을 형성하세요.
이 단계에서는 중심 탄소원자(C)가 안정적인지 여부를 확인해야 합니다.
중심 탄소(C) 원자의 안정성을 확인하려면 옥텟을 형성하는지 여부를 확인해야 한다.
불행히도 여기에서는 탄소 원자가 옥텟을 형성하지 않습니다. 탄소는 전자가 4개밖에 없어 불안정합니다.
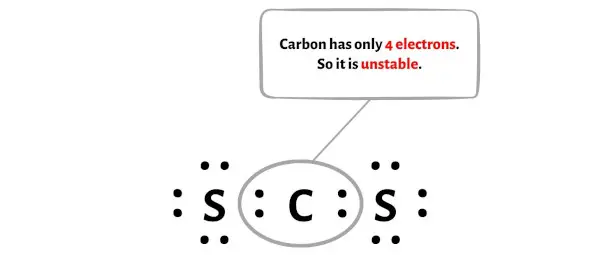
이제 이 탄소 원자를 안정하게 만들려면 외부 황 원자의 전자쌍을 이동시켜 탄소 원자가 8개의 전자(즉, 1옥텟)를 가질 수 있도록 해야 합니다.
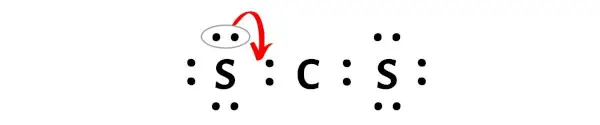
그러나 한 쌍의 전자를 이동시킨 후에도 탄소 원자는 6개의 전자만 갖고 있기 때문에 여전히 옥텟을 형성하지 않습니다.

다시 말하지만, 우리는 다른 황 원자로부터 여분의 전자쌍을 이동시켜야 합니다.

이 전자쌍을 이동시킨 후, 중앙 탄소 원자는 2개의 전자를 더 받게 되며 총 전자 수는 8개가 됩니다.
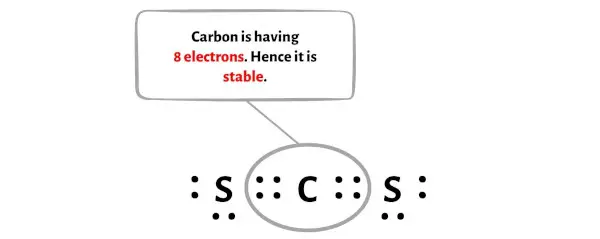
위의 이미지에서 탄소 원자가 옥텟을 형성하는 것을 볼 수 있습니다.
그러므로 탄소 원자는 안정적입니다.
이제 CS2의 루이스 구조가 안정적인지 여부를 확인하는 마지막 단계로 넘어가겠습니다.
6단계: 루이스 구조의 안정성 확인
이제 CS2의 루이스 구조의 안정성을 확인해야 하는 마지막 단계에 이르렀습니다.
루이스 구조의 안정성은 형식 전하 개념을 사용하여 검증할 수 있습니다.
간단히 말해서, 이제 우리는 CS2 분자에 존재하는 탄소(C)와 황(S) 원자의 형식 전하를 찾아야 합니다.
공식세를 계산하려면 다음 공식을 사용해야 합니다.
형식 전하 = 원자가 전자 – (결합 전자)/2 – 비결합 전자
아래 이미지에서 CS2 분자의 각 원자에 대한 결합 전자 와 비결합 전자 의 수를 확인할 수 있습니다.
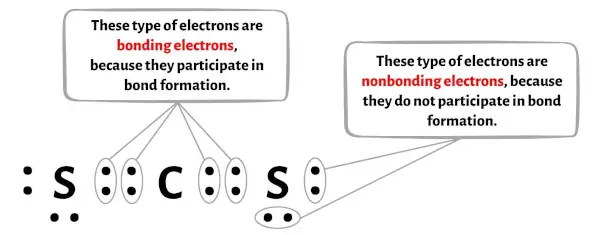
탄소 원자(C)의 경우:
원자가 전자 = 4 (탄소가 14족에 속하기 때문)
결합 전자 = 8
비결합 전자 = 0
황(S) 원자의 경우:
원자가 전자 = 6 (황이 16족에 속하기 때문)
결합 전자 = 4
비결합 전자 = 4
| 공식적인 고발 | = | 원자가 전자 | – | (전자 결합)/2 | – | 비결합 전자 | ||
| VS | = | 4 | – | 8/2 | – | 0 | = | 0 |
| 에스 | = | 6 | – | 4/2 | – | 4 | = | 0 |
위의 형식 전하 계산을 보면 탄소(C) 원자 뿐만 아니라 황(S) 원자도 형식 전하가 “0” 임을 알 수 있습니다.
이는 CS2의 위 루이스 구조가 안정적이고 CS2의 위 구조에 더 이상 변화가 없음을 나타냅니다.
위 CS2의 루이스 도트 구조에서는 각 결합전자쌍(:)을 단일결합(|)으로 나타낼 수도 있습니다. 그렇게 하면 CS2의 루이스 구조는 다음과 같습니다.
위의 모든 단계를 완전히 이해하셨기를 바랍니다.
더 많은 연습과 더 나은 이해를 위해 아래 나열된 다른 루이스 구조를 시도해 볼 수 있습니다.
더 나은 이해를 위해 다음 루이스 구조를 시도해 보세요(또는 적어도 확인하세요).
