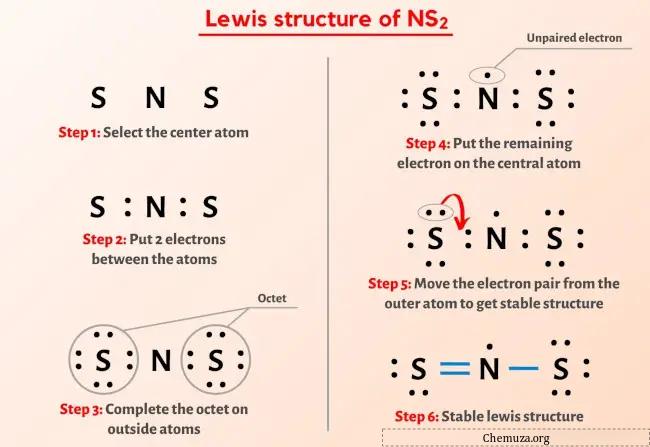
그럼 위 이미지는 이미 보셨죠?
위의 이미지를 간단히 설명하겠습니다.
NS2 루이스 구조는 중앙에 두 개의 황(S) 원자로 둘러싸인 질소(N) 원자가 있습니다. 질소(N) 원자와 각 황(S) 원자 사이에는 이중 결합 1개와 단일 결합 1개가 있습니다. 질소(N) 원자에 1개의 비공유전자쌍, 이중결합(S) 황 원자에 2개의 비공유전자쌍, 단일결합(S) 황 원자에 3개의 비공유전자쌍이 있습니다.
NS2의 루이스 구조에 대한 위의 이미지에서 아무것도 이해하지 못했다면 저와 함께 있으면 NS2 의 루이스 구조를 그리는 방법에 대한 자세한 단계별 설명을 얻을 수 있습니다.
그럼 NS2의 루이스 구조를 그리는 단계로 넘어가겠습니다.
NS2 루이스 구조를 그리는 단계
1단계: NS2 분자의 총 원자가 전자 수 찾기
NS2 분자 의 총 원자가 전자 수를 찾으려면 먼저 황 원자뿐만 아니라 질소 원자에 존재하는 원자가 전자를 알아야 합니다.
(가전자는 모든 원자의 가장 바깥쪽 궤도 에 존재하는 전자입니다.)
여기에서는 주기율표를 이용하여 질소와 황의 원자가전자를 쉽게 찾는 방법을 알려드리겠습니다.
NS2 분자의 총 원자가 전자
→ 질소 원자에 의해 주어진 원자가 전자:
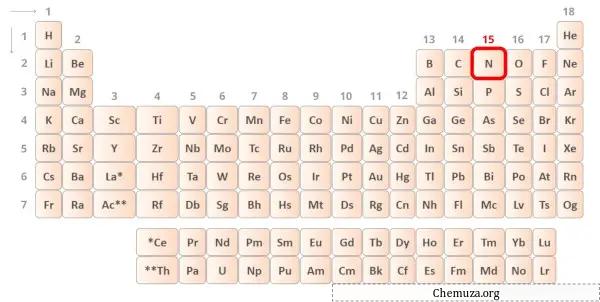
질소는 주기율표 15족에 속하는 원소입니다. [1] 따라서 질소에 존재하는 원자가 전자는 5 입니다.

위 이미지와 같이 질소 원자에 존재하는 5개의 원자가 전자를 볼 수 있습니다.
→ 황 원자에 의해 주어진 원자가 전자:
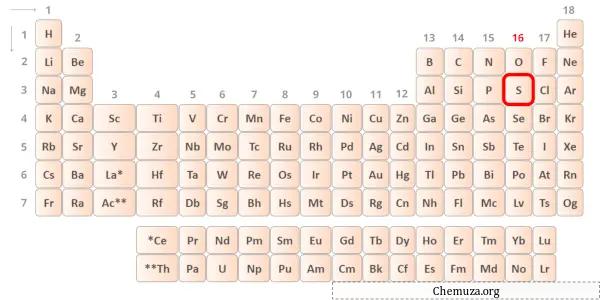
황은 주기율표 16족의 원소이다. [2] 따라서 황에 존재하는 원자가 전자는 6 입니다.
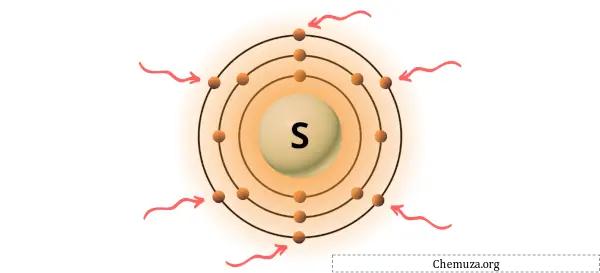
위 이미지와 같이 황 원자에 존재하는 6개의 원자가 전자를 볼 수 있습니다.
그래서,
NS2 분자의 총 원자가 전자 = 1개의 질소 원자가 제공하는 원자가 전자 + 2개의 황 원자가 제공하는 원자가 전자 = 5 + 6(2) = 17 .
2단계: 중심 원자 선택
중심 원자를 선택하려면 전기 음성도 가 가장 낮은 원자가 중심에 남아 있다는 것을 기억해야 합니다.
이제 여기서 주어진 분자는 NS2이고 질소(N) 원자와 황(S) 원자를 포함합니다.
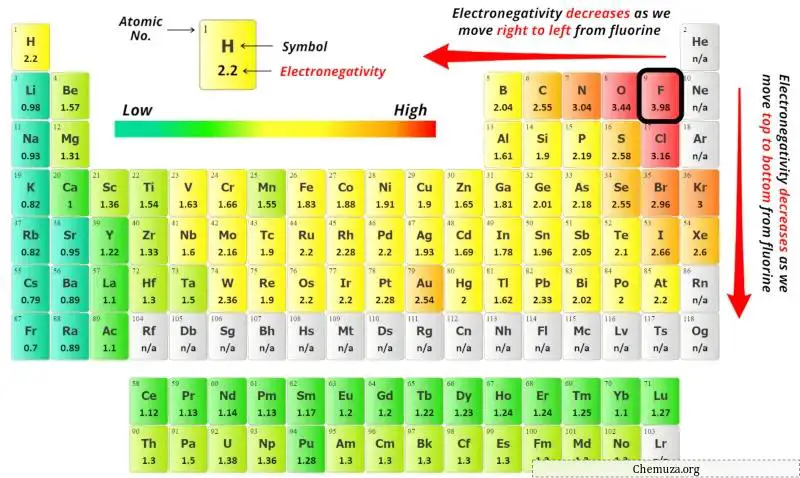
위의 주기율표에서 질소(N) 원자와 황(S) 원자의 전기음성도 값을 확인할 수 있습니다.
질소(N)와 황(S)의 전기음성도 값을 비교하면 질소 원자의 전기음성도가 덜합니다 .
여기서 질소(N) 원자가 중심 원자이고 황(S) 원자가 외부 원자이다.

3단계: 각 원자 사이에 전자쌍을 배치하여 각 원자를 연결합니다.
이제 NS2 분자에서는 질소(N) 원자와 황(S) 원자 사이에 전자쌍을 놓아야 합니다.
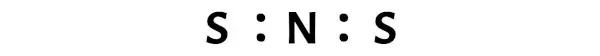
이는 NS2 분자 내에서 질소(N)와 황(S)이 화학적으로 결합되어 있음을 나타냅니다.
4단계: 외부 원자를 안정하게 만듭니다. 나머지 원자가 전자쌍을 중심 원자에 놓습니다.
이 단계에서는 외부 원자의 안정성을 확인해야 합니다.
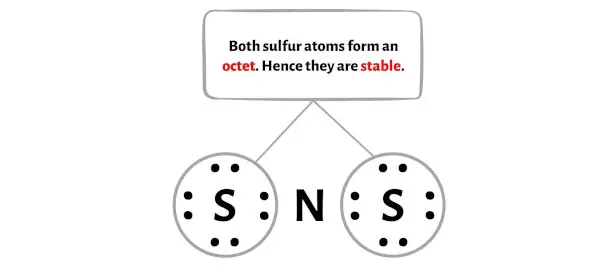
여기 NS2 분자의 스케치에서 외부 원자가 황 원자임을 알 수 있습니다.
이러한 외부 황 원자는 옥텟을 형성하므로 안정적입니다.
또한 1단계에서는 NS2 분자에 존재하는 총 원자가 전자 수를 계산했습니다.
NS2 분자에는 총 17개의 원자가 전자가 있으며 이 중 16개의 원자가 전자 만이 위 다이어그램에 사용되었습니다.
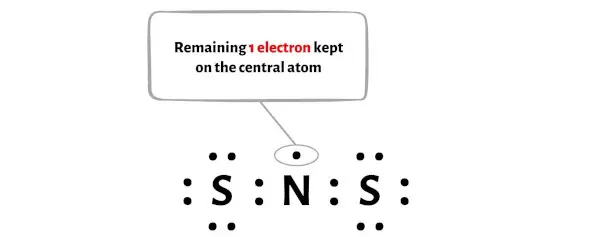
따라서 남은 전자의 수 = 17 – 16 = 1 .
NS2 분자의 위 다이어그램에서 중앙 질소 원자에 이 전자 1개 를 배치해야 합니다.
이제 다음 단계로 넘어가겠습니다.
5단계: 중심 원자의 옥텟을 확인합니다. 옥텟이 없으면 고립전자쌍을 이동하여 이중결합이나 삼중결합을 형성하세요.
이 단계에서는 중심 질소(N) 원자가 안정적인지 여부를 확인해야 합니다.
중심 질소(N) 원자의 안정성을 확인하려면 옥텟을 형성하는지 여부를 확인해야 한다.
불행하게도 질소 원자는 여기서 옥텟을 형성하지 않습니다. 질소는 전자가 5개밖에 없어 불안정합니다.
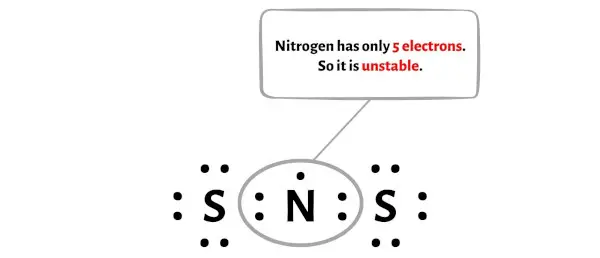
이제 이 질소 원자를 안정하게 만들려면 외부 황 원자에서 전자쌍을 이동시켜 질소 원자가 더욱 안정될 수 있도록 해야 합니다.
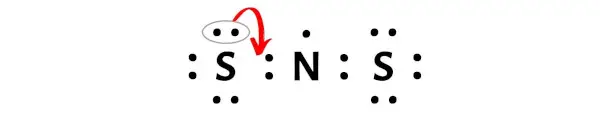
이 전자쌍을 이동시킨 후, 중심 질소 원자는 2개의 전자를 더 받게 되고 총 전자는 7개가 됩니다.
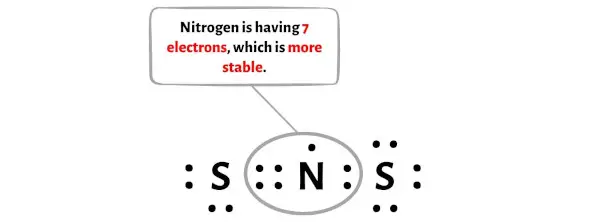
질소는 전자 7개를 갖고 있기 때문에 옥텟을 형성하지 않는다는 것을 알 수 있습니다. 이제 전자쌍을 더 많이 이동시키려고 하면 7 + 2 = 9개의 전자가 있게 됩니다.
그리고 질소 원자는 9개의 전자를 보유할 수 있는 능력이 없습니다. 따라서 위의 NS2 루이스 구조(질소 원자에 전자 7개 포함)는 안정적입니다.
위 NS2의 루이스 도트 구조에서는 각 결합전자쌍(:)을 단일결합(|)으로 나타낼 수도 있습니다. 그렇게 하면 NS2의 루이스 구조가 다음과 같이 됩니다.
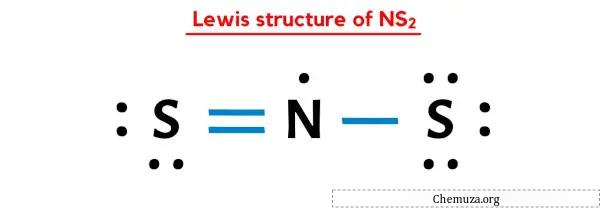
위의 모든 단계를 완전히 이해하셨기를 바랍니다.
더 많은 연습과 더 나은 이해를 위해 아래 나열된 다른 루이스 구조를 시도해 볼 수 있습니다.
더 나은 이해를 위해 다음 루이스 구조를 시도해 보세요(또는 적어도 확인하세요).
