酸化ホウ素 (B2O3) は、ホウ素と酸素の化学結合によって形成される化合物です。融点が高いため、ガラスや陶磁器の製造に使用されます。
| IUPAC名 | 酸化ホウ素 |
| 分子式 | B2O3 |
| CAS番号 | 1303-86-2 |
| 同義語 | 三酸化三ホウ素、酸化ホウ素、酸化ホウ素(III) |
| インチチ | InChI=1S/B2O3/c3-1-5-2(4)6-1 |
酸化ホウ素の性質
酸化ホウ素の配合
酸化ホウ素の化学式は B2O3 です。化合物中のホウ素原子と酸素原子の比率を表します。指数番号は、各酸化ホウ素分子に 2 つのホウ素原子と 3 つの酸素原子が存在することを示しています。
酸化ホウ素のモル質量
酸化ホウ素のモル質量は、その構成元素の原子質量を加算することで計算できます。ホウ素の原子量は 10.81 g/mol ですが、酸素の原子量は 16.00 g/mol です。原子質量にそれぞれの原子数を掛けて加算することにより、酸化ホウ素のモル質量は 69.62 g/mol と求められます。
酸化ホウ素の沸点
酸化ホウ素は、摂氏約 1,860 度の高い沸点を持っています。これは、通常の大気圧では、酸化ホウ素を液体状態から気体状態に変換するにはかなりのエネルギーが必要であることを意味します。
酸化ホウ素の融点
酸化ホウ素の融点は約450℃です。この温度では、固体の酸化ホウ素が液体状態に変化します。融点が比較的低いため、さまざまな産業用途に適しています。
酸化ホウ素の密度 g/mL
酸化ホウ素の密度は約 2.46 g/mL です。密度とは、物質の単位体積あたりの質量を指します。酸化ホウ素の密度は、酸化ホウ素が比較的高密度であることを示しており、ほとんどの液体中を流れることができます。
酸化ホウ素の分子量
酸化ホウ素の分子量はモル質量とも呼ばれ、69.62 g/mol です。この値は化合物の 1 モルの質量を表し、特定のサンプル中の酸化ホウ素の量を計算するのに役立ちます。
酸化ホウ素の構造
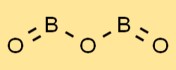
酸化ホウ素は、三方晶系の平面状 BO3 ユニットの配列を特徴とする独特の構造を持っています。ホウ素原子は、三角形に配置された 3 つの酸素原子に囲まれています。この配置により、酸化ホウ素に特有の特性と安定性が与えられます。
酸化ホウ素の溶解度
酸化ホウ素は、水およびほとんどの有機溶媒に不溶です。硫酸や塩酸などの酸に対する溶解度は限られています。この溶解度の低さは、ガラスやセラミックの製造などのさまざまな用途における安定性と有用性に貢献します。
| 外観 | 白色固体 |
| 比重 | 2.46g/ml |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 69.62 g/モル |
| 密度 | 2.46g/ml |
| 融合点 | 450℃ |
| 沸点 | 1860℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 不溶性 |
| 溶解性 | 硫酸や塩酸などの酸に対する溶解度が限られている |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
引火点、蒸気圧、蒸気密度、pKa、pH などの一部の特性は、酸化ホウ素には適用されないか、報告されていないことに注意してください。
酸化ホウ素の安全性と危険性
酸化ホウ素には、安全性と危険性について一定の考慮事項があります。酸化ホウ素の粉末や粉塵に直接接触すると、皮膚、目、呼吸器系を刺激する可能性があります。慎重に取り扱い、手袋やゴーグルなどの適切な個人用保護具を使用することが重要です。酸化ホウ素粒子を吸入すると呼吸器官への炎症を引き起こす可能性があるため、換気の良い場所で作業することをお勧めします。誤って摂取した場合は、直ちに医師の診察を受けてください。酸化ホウ素は不燃性で引火点がありません。他の化学物質と同様に、安全な使用を確保するために、適切な取り扱いと保管のガイドラインに従うことをお勧めします。
| ハザードシンボル | 未分類 |
| セキュリティの説明 | 皮膚や目との接触を避けてください。換気の良い場所で使用してください。保護具を着用してください。 |
| 国連識別番号 | 適用できない |
| HSコード | 2810.00.2000 |
| 危険等級 | 未分類 |
| 梱包グループ | 適用できない |
| 毒性 | 低〜中程度の毒性。接触または吸入により炎症を引き起こす可能性があります。 |
酸化ホウ素には危険記号、国連識別、危険等級、包装グループが含まれていないことに注意してください。酸化ホウ素の取り扱いおよび使用の際は、暴露のリスクを最小限に抑え、安全な使用を確保するために、一般的な安全ガイドラインと慣行に従うことが重要です。
酸化ホウ素の合成方法
酸化ホウ素はさまざまな方法で合成できます。広く使用されているアプローチは、酸素または空気の存在下でホウ素元素を加熱して酸化ホウ素を生成することです。別の方法では、三塩化ホウ素 (BCl3) や三臭化ホウ素 (BBr3) などのハロゲン化ホウ素を水と反応させ、酸化ホウ素を生成します。
さらに、窒化ホウ素や三硫化ホウ素などのホウ素含有化合物は、水による加水分解を受けて酸化ホウ素を生成する可能性があります。ホウ酸ナトリウムやホウ砂などのホウ酸塩も熱にさらされると熱分解して酸化ホウ素が生成されます。
特定の合成方法の選択は、酸化ホウ素の目的の純度、量、および用途によって決まることに注意することが重要です。各方法には利点があり、さまざまな状況に適している場合があります。
酸化ホウ素の用途
酸化ホウ素は、さまざまな産業でさまざまな用途に使用されています。その用途の一部を次に示します。
- ガラスとセラミックの製造: 酸化ホウ素は、ガラスとセラミックの製造における重要な成分です。ガラス製品に耐熱性、透明性、耐久性などの望ましい特性を与えます。
- 難燃剤: メーカーは、繊維、プラスチック、木製品などの材料に難燃剤として酸化ホウ素を使用しています。酸化ホウ素はこれらの材料の可燃性を低減し、安全性を高めます。
- ホウケイ酸ガラス: 酸化ホウ素は、低熱膨張と高い耐熱性で知られるホウケイ酸ガラスの成分として重要な役割を果たします。業界では、このタイプのガラスが実験室機器、台所用品、およびハイエンドの光学機器に使用されています。
- 特殊繊維: ホウ素繊維や窒化ホウ素繊維などの特殊繊維の製造には、酸化ホウ素が使用されます。これらの繊維は優れた機械的特性と熱的特性を備えているため、航空宇宙、自動車、ハイテク産業に適しています。
- ホウ素化学物質: 酸化ホウ素は、ホウ酸塩や水素化ホウ素などのさまざまなホウ素化学物質を合成するための前駆体として機能します。これらの化学物質は、農業、製薬、エネルギー貯蔵システムに応用されています。
- はんだ付け用フラックスと助剤: 酸化ホウ素は材料の融点を下げ、流動性を改善するため、冶金プロセスにおいて効果的なフラックスとなります。はんだ付け剤として使用すると、金属表面の接着が向上します。
- 触媒: 酸化ホウ素触媒は望ましい反応を促進し、反応速度を高めるため、化学反応に恩恵をもたらします。
- 半導体産業: 酸化ホウ素は半導体の製造において重要な役割を果たします。これは、シリコンの電気的特性を積極的に変更するドーピング材料として機能します。
酸化ホウ素の幅広い用途は、さまざまな産業におけるその多用途性と重要性を際立たせており、技術、安全性、材料科学の進歩に貢献しています。
質問:
Q: B2O3 中のホウ素の酸化状態は何ですか?
A: B2O3 のホウ素の酸化状態は +3 です。
Q: 酸化ホウ素の実験式は何ですか?
A: 酸化ホウ素の実験式は B2O3 です。
Q: ホウ素の表面濃度はいつ酸化物の成長速度に影響しますか?
A: ホウ素の表面濃度は、ホウ素が酸化プロセスでドーパントまたは触媒として作用する場合、酸化物の成長速度に影響します。
Q: ボリア酸化ホウ素とは何ですか?
A: ボリアとしても知られる酸化ホウ素は、化学式 B2O3 の化合物です。
Q: ホウ素の酸化数は何ですか?
A: ホウ素の酸化数は一般に +3 です。
Q: ホウ素は酸素が欠乏した材料の酸化を遅らせますか?
A: ホウ素は酸化ホウ素を形成するのに酸素を必要とするため、酸素欠乏材料の酸化を遅らせることはありません。
Q: CuO 中の HBO2 のホウ素の酸化状態は何ですか?
A: HBO2 のホウ素の酸化状態は +3 です。
Q: 何モルの B2O3 が生成できますか?
A: 形成される B2O3 のモル数は、反応に使用される反応物の量によって異なります。
Q: B2O3 はイオンですか、それとも分子ですか?
A: B2O3 はイオン性化合物です。
Q: どのペアが塩基性の高い順にリストされていますか? PBO < SiO2 B2O3 < Li2O
A: 塩基性の高い順にリストされているペアは、B2O3 < Li2O < PBO < SiO2 です。
Q: B2H6 + O2 → B2O3 + H2O、この方程式は平衡していますか?
A: いいえ、方程式のバランスが取れていません。これには、バランスの取れた方程式を達成するための調整が必要です。
Q: 210.0 ポンドの B2O3 からどのくらいのホウ素が得られますか?
A: 210.0 ポンドの B2O3 から得られるホウ素の量は、反応のモル質量と化学量論によって異なります。
