酸化ニッケル(II)は、化学式NiOの化合物です。これは黒色の固体で、触媒として、またセラミックや顔料の製造に一般的に使用されます。
| IUPAC名 | 酸化ニッケル(II) |
| 分子式 | NiO |
| CAS番号 | 1313-99-1 |
| 同義語 | 酸化ニッケル、一酸化ニッケル、酸化Ni(II) |
| インチチ | InChI=1S/Ni.O |
酸化ニッケル(II)の性質
酸化ニッケル(II)の式
一酸化ニッケルの化学式は NiO です。これは 1 つのニッケル (Ni) 原子と 1 つの酸素 (O) 原子で構成されており、シンプルでわかりやすい式になります。
酸化ニッケル(II)のモル質量
一酸化ニッケルのモル質量は、その構成元素の原子質量を加算することで計算できます。 NiO の場合、モル質量は約 74.69 グラム/モル (g/mol) です。
酸化ニッケル(II)の沸点
一酸化ニッケルは沸点に達する前に分解するため、明確な沸点を持ちません。加熱すると、構成元素であるニッケルと酸素に分解されます。
酸化ニッケル(II) 融点
一酸化ニッケルの融点は約摂氏 1984 度 (1984 °C) です。この温度では、固体の NiO が液体状態に変わります。
酸化ニッケル(II)の密度 g/mL
一酸化ニッケルの密度は約 6.67 グラム/ミリリットル (g/mL) です。この値は、特定の体積に詰め込まれた質量の量を示し、物質の緻密さの尺度になります。
酸化ニッケル(II)の分子量
一酸化ニッケルの分子量は、構成元素の原子量を加算して計算されます。 NiO の場合、分子量は約 74.69 グラム/モル (g/mol) です。
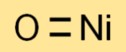
酸化ニッケル(II)の構造
一酸化ニッケルは立方晶系の結晶構造を持っています。これは、規則的な繰り返しパターンで配置されたニッケルイオン (Ni2+) と酸化物イオン (O2-) で構成されています。この構造は、その特徴的な特性と動作に貢献します。
酸化ニッケル(II)の溶解度
一酸化ニッケルは水に溶けにくいです。溶解度が限られており、水に少量しか溶解しません。ただし、酸と反応して可溶性ニッケル塩を形成し、ある程度の化学反応性を示すことがあります。
| 外観 | ソリッドブラック |
| 比重 | 6.67g/ml |
| 色 | 黒 |
| 匂い | 無臭 |
| モル質量 | 74.69 g/モル |
| 密度 | 6.67g/ml |
| 融合点 | 1984℃ |
| 沸点 | 分解された |
| フラッシュドット | 適用できない |
| 水への溶解度 | 難溶性 |
| 溶解性 | 酸に可溶で、可溶性ニッケル塩を形成します。 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 適用できない |
| pH | 中性 |
引火点、蒸気圧、pKa などの一部の特性は、一酸化ニッケルには適用できない、または利用できないことに注意してください。
酸化ニッケル(ii)の安全性と危険性
一酸化ニッケルには、安全上の考慮事項と危険性が伴います。慎重に扱うことが重要です。皮膚、目に直接接触したり、粉塵や蒸気を吸入したりすることは避けてください。これにより、人によっては皮膚の炎症やアレルギー反応を引き起こす可能性があります。飲み込んだり吸入した場合は、直ちに医師の診察が必要です。一酸化ニッケルは可燃性が高いとは考えられていませんが、可燃性物質にさらされると火災を引き起こす可能性があります。換気の良い場所で保管および取り扱うことが重要です。一酸化ニッケルを扱う場合は、潜在的なリスクを最小限に抑えるために、手袋やゴーグルなどの適切な個人用保護具を着用する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | 取り扱い注意。直接接触や吸入を避けてください。適切な保護具を使用してください。必要に応じて医師の診察を受けてください。 |
| 国連識別番号 | 適用できない |
| HSコード | 2825.70.10 |
| 危険等級 | 未分類 |
| 梱包グループ | 未分類 |
| 毒性 | 飲み込んだり吸入すると有害と考えられます。皮膚の炎症やアレルギー反応を引き起こす可能性があります。 |
一酸化ニッケルには特定の危険記号、国連識別子、危険等級、包装グループが付与されていないことに注意してください。提供される安全性情報は、一酸化ニッケルの取り扱いと使用に関連する一般知識と注意事項に基づいています。正確かつ詳細な情報を得るには、特定の安全データシート (SDS) を参照し、推奨される安全慣行に従うことが不可欠です。
酸化ニッケル(ii)の合成方法
一酸化ニッケルを合成するにはいくつかの方法があります。一般的なアプローチは、炭酸ニッケルや水酸化ニッケルなどのニッケル化合物の熱分解です。この方法では、酸素の非存在下で特定の前駆体化合物を加熱して一酸化ニッケルを形成します。
別の方法には、金属ニッケルの酸化が含まれます。金属ニッケルは高温で酸素または空気と反応して一酸化ニッケルを生成することがあります。このプロセスは、空気または酸素雰囲気中で金属ニッケルをか焼または焙焼して一酸化ニッケルを生成することによって実行されます。
沈殿反応を使用して、塩化ニッケルや硝酸ニッケルなどのニッケル塩を水酸化ナトリウムや水酸化アンモニウムなどのアルカリ溶液と反応させて一酸化ニッケルを合成します。この反応により、一酸化ニッケルの沈殿が形成されます。
ゾルゲル合成も実行可能な方法です。これには、溶液中でのニッケルアルコキシドなどの適切なニッケル前駆体の加水分解と縮合が含まれます。沈殿反応中に形成されたゲルを乾燥および焼成して、一酸化ニッケルを取得します。
一酸化ニッケルの合成には電着技術を使用します。電解質溶液に浸したニッケル電極に電流を流すと、電極の表面に一酸化ニッケルが形成されます。
各方法には独自の利点があるため、合成方法を選択する場合は、目的の純度、拡張性、特定のアプリケーション要件などの要素を考慮する必要があります。
酸化ニッケル(ii)の用途
一酸化ニッケルは、その独特の特性により、さまざまな産業でさまざまな用途に使用されています。一般的なアプリケーションのいくつかを次に示します。
- 触媒: 一酸化ニッケルは、水素化や酸化プロセスなどのさまざまな化学反応を積極的に触媒し、反応物質から目的の製品への変換を促進します。
- セラミック:セラミック材料の製造において、一酸化ニッケルは着色剤として積極的に機能し、セラミックの釉薬や顔料の特定の色やパターンの実現に積極的に貢献します。
- バッテリー: 充電式ニッケルカドミウム (NiCd) バッテリーとニッケル水素 (NiMH) バッテリーは、一酸化ニッケルを正極材料として積極的に使用し、電気エネルギーの貯蔵と放出を積極的に可能にします。
- ガスセンサー: 一酸化ニッケルは、それをベースにしたセンサーで使用されると、ガス検出用途で一酸化炭素 (CO) や二酸化窒素 (NO2) などのガスを積極的に検出します。
- ガラス製造: ガラス業界では、ガラス製品にさまざまな色を与えるために一酸化ニッケルを積極的に使用しており、それによって緑、茶色、黒色などの色ガラスの製造に積極的に貢献しています。
- 導電性コーティング: 一酸化ニッケルは導電性コーティングの成分として積極的に機能し、ガラスやプラスチックなどの材料に塗布すると積極的に導電性を発揮します。
- 燃料電池: 一酸化ニッケルは固体酸化物型燃料電池 (SOFC) の構成要素として積極的に機能し、カソード材料として積極的に作用し、燃料電池内の電気化学反応に関与します。
- 触媒サポート: 一酸化ニッケルは他の触媒のサポート材料として積極的に機能し、その安定性と性能を積極的に向上させます。
一酸化ニッケルの多様な用途は、さまざまな産業におけるその重要性を浮き彫りにし、その有用性と多用途性を強調しています。
質問:
Q: 酸化ニッケル(II)の式は何ですか?
A: 酸化ニッケル(II)の式はNiOです。
Q: 酸化ニッケル(II)が硝酸と反応するとどのような塩が形成されますか?
A: 酸化ニッケル(II) と硝酸の反応により、硝酸ニッケル(II) (Ni(NO3)2) が生成されます。
Q: ニッケル(II)はどの電圧でニッケル(III)に酸化しますか?
A: ニッケル(II)は、約 +1.63V の電圧で酸化してニッケル(III)になります。
Q: 写真のように、Ni(s) がニッケル(II) イオンに酸化されるとどうなりますか?
A: Ni(s) がニッケル(II) イオンに酸化される際に電子が失われ、その結果 Ni2+ イオンが形成されます。
Q: 13.3 g のニッケルを製造するには、どのくらいの質量の酸化ニッケル(II) とアルミニウムを使用する必要がありますか?
A: 13.3 g のニッケルを生成するのに必要な酸化ニッケル(II) とアルミニウムの質量は、関与する特定の反応と化学量論によって異なります。
