酢酸ナトリウム (C2H3NaO2) は、Na+ イオンと C2H3O2- イオンから構成される化合物です。これは食品添加物として、また透析液などの医療用途や特定の細菌の炭素源として一般的に使用されています。
| IUPAC名 | 酢酸ナトリウム |
| 分子式 | C2H3NaO2 |
| CAS番号 | 127-09-3 |
| 同義語 | 酢酸ナトリウム、エタン酸ナトリウム、酢酸ナトリウム |
| インチチ | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
酢酸ナトリウムの性質
酢酸ナトリウムの配合
酢酸ナトリウムの化学式はNaC2H3O2です。これは、化合物が 1 つの Na+ イオンと 1 つの C2H3O2- イオンで構成されていることを示します。 C2H3O2- イオンは、1 つの炭素原子、2 つの酸素原子、および 3 つの水素原子で構成されています。この式は、化学反応の化学量論を決定したり、さまざまな条件下での化合物の挙動を予測したりするのに役立ちます。
酢酸ナトリウムのモル質量
NaC2H3O2 のモル質量は 82.03 g/mol です。これは、1 モルの NaC2H3O2 の重さが 82.03 グラムであることを意味します。モル質量は、化合物内の各元素の原子質量を加算することによって計算されます。ナトリウムの質量は 22.99 g/mol、炭素の質量は 12.01 g/mol、水素の質量は 1.01 g/mol、酸素の質量は 16.00 g/mol です。 NaC2H3O2 のモル質量は、特定のサンプル中に存在する化合物の量を決定するのに役立ちます。
酢酸ナトリウムの沸点
NaC2H3O2 の沸点は 881°C (1,618°F) です。沸点とは、物質が液体から気体に変化する温度です。 NaC2H3O2 の沸点が高いのは、ナトリウムイオンと酢酸イオン間の強いイオン結合によるものです。高温になると、これらの結合が壊れ、化合物が蒸発します。
酢酸ナトリウム 融点
NaC2H3O2 の融点は 324°C (615°F) です。融点とは、物質が固体から液体に変化する温度です。 NaC2H3O2 の融点が高いのも、ナトリウムイオンと酢酸イオン間の強いイオン結合によるものです。高温ではこれらの結合が弱まり、化合物が溶けます。
酢酸ナトリウムの密度 g/mL
NaC2H3O2 の密度は 1.45 g/mL です。密度は、物質の単位体積あたりの質量です。 NaC2H3O2 の密度が高いのは、その分子がコンパクトに配置されているためです。 NaC2H3O2 の密度は、溶液中の濃度に応じて変化します。
酢酸ナトリウムの分子量
NaC2H3O2 の分子量は 82.03 g/mol です。化合物 1 モルの質量です。分子量は、特定のサンプル中の化合物の量を決定したり、化学反応の化学量論を計算したりするのに役立ちます。
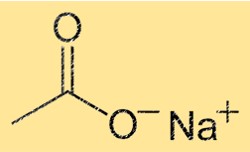
酢酸ナトリウムの構造
NaC2H3O2 は繰り返し単位 Na(CH3COO) を含む結晶構造を持っています。これは、結晶の各単位胞に 1 つのナトリウムイオンと 1 つの酢酸イオンが含まれていることを意味します。 Na+ イオンは 6 つの酸素原子に囲まれていますが、C2H3O2- イオンは 1 つの炭素原子、2 つの酸素原子、および 3 つの水素原子で構成されています。イオン間の強いイオン結合により、結晶に安定性と高い融点と沸点が与えられます。
| 外観 | 白色の結晶固体 |
| 比重 | 20℃で1.45 |
| 色 | 無色または白色 |
| 匂い | 無臭 |
| モル質量 | 82.03 g/モル |
| 密度 | 1.45 g/cm3 (20°C) |
| 融合点 | 324°C (615°F) |
| 沸点 | 881°C (1618°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 820g/L(20℃) |
| 溶解性 | 水、エタノール、アセトンに可溶 |
| 蒸気圧 | 239.2℃で1mmHg |
| 蒸気密度 | 適用できない |
| pKa | 4.76 (25℃にて) |
| pH | 7 (1% 溶液) |
酢酸ナトリウムの安全性と危険性
NaC2H3O2 は一般に、適切な予防措置を講じた場合、安全に取り扱い、使用できると考えられています。ただし、皮膚や目の炎症を引き起こす可能性があり、大量に摂取または吸入すると胃腸の炎症、呼吸器疾患、中枢神経系の抑制を引き起こす可能性があります。 NaC2H3O2 は、強力な酸化剤、酸、アルカリと反応して、熱や有害ガスを発生する可能性があります。 NaC2H3O2 を取り扱うときは、手袋や保護眼鏡などの適切な個人用保護具を着用することが重要です。 NaC2H3O2 は、不適合物質から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。誤って暴露または摂取した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | なし |
| セキュリティの説明 | 皮膚や目との接触を避けてください。摂取したり吸入したりしないでください。換気の良い場所で使用してください。 |
| 国連識別番号 | 規制されていません |
| HSコード | 2915.21.00 |
| 危険等級 | 未分類 |
| 梱包グループ | 適用できない |
| 毒性 | 低毒性 |
酢酸ナトリウムの合成方法
NaC2H3O2 を合成するにはいくつかの方法がありますが、最も一般的な方法には酢酸と水酸化ナトリウムの中和反応が含まれます。反応式は次のとおりです。
CH3COOH + NaOH → CH3COONa + H2O
反応を実行するには、まず氷酢酸を水に溶解して酢酸溶液を調製します。撹拌しながら、溶液のpHが約7に達するまで水酸化ナトリウムを酢酸溶液にゆっくりと加えます。
この時点で、溶液には NaC2H3O2 と水が含まれます。固体の NaC2H3O2 を得るには、溶液が乾燥するまで弱火で蒸発させます。あるいは、溶液を室温まで放冷すると、NaC2H3O2 結晶が自然に沈殿します。
NaC2H3O2 を合成する別の方法には、無水酢酸と炭酸ナトリウムを反応させることが含まれます。反応式は次のとおりです。
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
この反応により、NaC2H3O2、二酸化炭素、一酸化炭素、水が生成されます。
反応混合物を蒸発乾固させ、次いで水中で結晶化させると、固体の形でNaC2H3O2が得られる。無水酢酸は高価であるため、この方法はほとんど使用されません。
酢酸ナトリウムの用途
NaC2H3O2 は、多くの産業および科学用途に使用できる多用途の化学物質です。一般的な用途のいくつかを次に示します。
- 緩衝剤: 化学および生物学的用途で緩衝剤として一般的に使用されます。安定したpHを維持し、酸性度の変動を防ぎます。
- 加熱パック: 加熱パックまたは加熱パッドの製造に使用されます。これらのバッグは小さく、体の特定の領域に熱を提供するために加熱できます。
- 食品添加物:食品添加物として、主に風味増強剤、pH調整剤、保存剤として使用されます。加工食品メーカーは通常、スナック、ソース、肉製品にそれを配合しています。
- 繊維産業: 繊維産業で染色および印刷助剤として使用されます。生地の染料の吸収性と色堅牢度を向上させるのに役立ちます。
- 化学合成:さまざまな化学反応の試薬として使用されます。アルコールを対応するハロゲン化アルキルに変換し、酢酸から無水酢酸を生成します。
- 医療用途: 血液透析などの医療用途や電解質溶液の成分として使用されます。
- 写真: 写真プリントやネガから未露光のハロゲン化銀を除去するための定着液として写真に使用されます。
質問:
Q: アミド合成における酢酸ナトリウムの目的は何ですか?
A: NaC2H3O2 は、出発物質のアミン基を脱プロトン化するための塩基としてアミド合成に使用されます。これにより、カルボン酸との反応が促進され、アミド結合が形成されます。
Q: アミド合成における酢酸ナトリウム溶液の目的は何ですか?
A: NaC2H3O2 溶液は、アミドの合成における塩基性触媒として使用されます。出発物質のアミン基の脱プロトン化を助け、カルボン酸に対する反応性を高めます。
Q: 酢酸ナトリウムがベースですか?
A: はい、NaC2H3O2 は塩基です。これは酢酸の共役塩基であり、水に溶解すると約 9 の pH を持ちます。
Q: 酢酸ナトリウムとは何ですか?
A: NaC2H3O2 は、化学式 NaCH3COO を持つ酢酸のナトリウム塩です。白色、無臭の結晶性の粉末で、水に溶けます。
Q: アセトフェネチジンアミドの合成における酢酸ナトリウム溶液の目的は何ですか?
A: アセトフェネチジンのアミド合成では、p-フェネチジンと無水酢酸の反応を促進する塩基性触媒として NaC2H3O2 溶液が使用されます。 p-フェネチジンのアミン基を脱プロトン化し、無水酢酸による求核攻撃に対して活性化するのに役立ちます。これにより、アセトフェネチジンが生成されます。
