過酸化マグネシウム (MgO2) は、マグネシウムと酸素から作られる化合物です。農業では、徐放性酸素の供給源として、また植物の成長を改善するための土壌改良材として一般的に使用されています。
| IUPAC名 | 過酸化マグネシウム |
| 分子式 | MgO2 |
| CAS番号 | 14452-57-4 |
| 同義語 | 二酸化マグネシウム、マグネシウム;過酸化物、Permag、Magics、Oxy-Gen、EINECS 215-217-9 |
| インチチ | InChI=1S/Mg.2O2/h;2*1H/q+2;;/p-2 |
過酸化マグネシウムの性質
過酸化マグネシウムの配合
過酸化マグネシウムの化学式は MgO2 です。これは、過酸化マグネシウム 1 分子にはマグネシウム原子 1 個と酸素原子 2 個が含まれていることを意味します。この式は、化合物に存在する原子の種類と数を特定し、過酸化マグネシウムが関与する化学反応の化学量論を決定するのに役立つため、重要です。
過酸化マグネシウムのモル質量
MgO2 のモル質量は 56,304 g/mol です。これは、1 モルの MgO2 に 56,304 グラムの化合物が含まれていることを意味します。モル質量は、化学反応に必要な物質の量を決定するのに役立つため、MgO2 の重要な特性です。
過酸化マグネシウムの沸点
MgO2 には沸騰する前に分解するため、設定された沸点がありません。加熱すると酸化マグネシウムと酸素ガスに分解します。 MgO2 のこの特性により、MgO2 はさまざまな用途で酸素源として役立ちます。
過酸化マグネシウムの融点
MgO2 の融点は 223°C です。これは、700℃を超える温度では固体化合物が液体に変わることを意味します。融点は、高温にさらされたときの化合物の挙動を決定するため、MgO2 の重要な特性です。
過酸化マグネシウムの密度 g/mL
MgO2 の密度は 2.41 g/mL です。これは、1 ミリリットルの MgO2 の重さが 2.41 グラムであることを意味します。密度は、特定の体積の化合物の質量を決定するのに役立つため、MgO2 の重要な特性です。
過酸化マグネシウムの分子量
MgO2 の分子量は 56.304 g/mol です。これは、MgO2 1 分子の質量が 56,304 原子質量単位であることを意味します。分子量は、化学反応に必要な物質の量を決定するのに役立つため、MgO2 の重要な特性です。
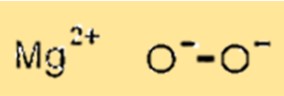
過酸化マグネシウムの構造
MgO2 は、格子構造の八面体サイトをマグネシウムイオンが占め、四面体サイトを酸素イオンが占める結晶構造を持っています。この結晶構造は MgO2 の物理的および化学的特性を決定するため、重要です。
| 財産 | 価値 |
| 外観 | 白い粉 |
| 比重 | 3.15 g/cm3 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 56.304 g/モル |
| 密度 | 2.41g/ml |
| 融合点 | 223℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 不溶性 |
| 溶解性 | 酸に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
過酸化マグネシウムの安全性と危険性
MgO2 は一般に、正しく取り扱われ、使用されれば安全であると考えられています。ただし、皮膚、目、呼吸器系を刺激する可能性があります。大量に摂取すると、胃腸の炎症、嘔吐、下痢を引き起こす可能性があります。粉末を取り扱う際は、粉末を吸い込まないようにし、保護服や保護具を着用することが重要です。 MgO2 は可燃性でも爆発性でもありませんが、酸や強力な酸化剤などの特定の化学物質と反応する可能性があります。偶発的な反応を避けるために、適切な保管と取り扱いが必要です。暴露または摂取した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | ああ、習さん |
| セキュリティの説明 | 過酸化マグネシウムは、吸入すると皮膚や目の炎症を引き起こす可能性があるほか、気道への炎症を引き起こす可能性があります。飲み込んだり皮膚に接触すると有害であり、目に重篤な損傷を引き起こす可能性があります。熱、炎、酸化剤にさらされると火災の危険もあります。 |
| 国連識別番号 | UN1479 |
| HSコード | 282910 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 過酸化マグネシウムは、吸入すると皮膚や目の炎症を引き起こす可能性があるほか、気道への炎症を引き起こす可能性があります。飲み込んだり皮膚に接触すると有害であり、目に重篤な損傷を引き起こす可能性があります。熱、炎、酸化剤にさらされると火災の危険もあります。 |
過酸化マグネシウムの合成法
MgO2 を合成するにはいくつかの方法があり、それぞれに長所と短所があります。
1 つの方法には、 MgOと過酸化水素の反応が含まれます。この方法では、 MgO を少量の水と混合してペーストを形成し、混合物をかき混ぜながら過酸化水素を加えます。結果として生じる生成物は、MgO2 と水です。
別の方法には、 Mg(OH)2と過酸化水素の反応が含まれます。化学者は、Mg(OH)2 を水に溶解して溶液を形成し、過酸化水素をゆっくりと加えながら混合物を撹拌します。結果として生じる生成物は、MgO2 と水です。
3 番目の方法では、金属マグネシウムと酸素ガスを高温で直接反応させます。この方法には特殊な装置が必要ですが、他の方法ほど一般的には使用されていません。
過酸化マグネシウムの用途
MgO2 は、次のようなさまざまな産業でさまざまな用途に使用されます。
- 環境への応用 – 汚染物質を分解するために、土壌および地下水浄化における酸素放出化合物として使用されます。
- 農業 – 植物の成長を促進する徐放性酸素特性により、肥料および土壌改良剤として使用されます。
- 医療用 – 口腔の健康のための美白剤および酸素供給剤として、一部の歯磨き粉配合物に使用されています。
- 化学品の製造 – エポキシ、過酸、ペルエステルなどの特殊化学品の製造に使用されます。
- 食品加工 – 小麦粉やその他の食品の漂白剤として使用されます。
- 繊維産業 – 繊維生産において漂白剤として使用されます。
- 水処理 – 酸素を放出し、有機化合物を分解することで水を浄化するために使用されます。
質問:
Q: 過酸化マグネシウムは何に使用されますか?
A: MgO2 は、環境用途、農業、医療分野、化学製造、食品加工、繊維産業、水処理などのさまざまな産業で使用されています。
Q: 過酸化水素と硫酸マグネシウムを混合すると何が生成しますか?
A: H2O2 と硫酸マグネシウムを混合すると、MgO2、水、酸素ガスが生成します。
Q: 過酸化マグネシウムは研究室で使用されますか?
A: はい、MgO2 は化学反応、水処理、環境衛生などのさまざまな目的で研究室で使用されています。
Q: マグネシウムは過酸化水素を分解しますか?
A: マグネシウムはそれ自体では H2O2 を分解しません。ただし、マグネシウムはヨウ化カリウムなどの触媒の存在下で H2O2 と反応して酸素ガスを放出する可能性があります。
Q: 式の単位として正しくないものは次のうちどれですか? k2o mgo2 al2o3 sro
A: Mgo2 は正しい式単位ではありません。酸化マグネシウムの正しい式単位は MgO です。
Q: この組み合わせた反応の生成物は何ですか? mgo + co2 mgo3 + c mgco3 mgo2 mgo + o2 co2 + o2
a: mgo と co2 の結合反応で生成される生成物は mgco3 です。
Q: Mgo2 は液体、気体、それとも固体ですか?
A: Mgo2 は固体化合物です。
