過酸化ナトリウム (Na2O2) は強力な酸化剤です。水と激しく反応して酸素を放出し、接触すると可燃物に発火する可能性があります。さまざまな化学反応や消毒剤として使用されます。
| IUPAC名 | 酸化ナトリウム |
| 分子式 | Na2O2 |
| CAS番号 | 1313-60-6 |
| 同義語 | 過酸化ナトリウム、超酸化ナトリウム、二酸化ナトリウム、二酸化ナトリウム、二酸化ナトリウム、NaO2、UN 1507 |
| インチチ | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
過酸化ナトリウムの性質
過酸化ナトリウムの配合
過酸化ナトリウムの化学式は Na2O2 です。これは、2 つのナトリウム カチオン (Na+) と過酸化物アニオン (O22-) で構成されるイオン性化合物です。過酸化ナトリウムの式は、化合物の化学組成を表すために使用され、その物質が関与する化学反応において重要です。
過酸化ナトリウムのモル質量
過酸化ナトリウム、化学式 Na2O2 のモル質量は 77.98 g/mol です。これは、2 つのナトリウム カチオン (Na+) と過酸化物アニオン (O22-) で構成されるイオン性化合物です。過酸化ナトリウムのモル質量は、さまざまな化学反応に必要な化合物の量を計算するために不可欠です。
過酸化ナトリウムの沸点
過酸化ナトリウムは沸点が 657°C (1215°F) と非常に高く、高温でも非常に安定しています。この化合物は沸点に達する前に分解し、酸素ガスを放出し、酸化ナトリウムが残ります。過酸化ナトリウムは沸点が高いため、高い熱安定性が必要な高温反応や工業プロセスで役立ちます。
過酸化ナトリウムの融点
過酸化ナトリウムの融点は 675°C (1247°F) で、他の一般的な物質と比べて比較的高いです。それは溶けて黄白色の液体を形成し、融点を超えると分解して酸素ガスを放出し、酸化ナトリウムを形成します。過酸化ナトリウムは融点が高いため、高温での化学反応に役立ちます。
過酸化ナトリウムの密度 g/ml
過酸化ナトリウムの密度は 2.805 g/mL です。水よりも密度が高い、白から黄色がかった粉末です。過酸化ナトリウムは高密度であるため、漂白、消毒、その他の化学物質の製造など、さまざまな工業プロセスで役立ちます。
過酸化ナトリウムの分子量
過酸化ナトリウムの分子量は 77.98 g/mol です。これは、2 つのナトリウム カチオン (Na+) と 1 つの過酸化物アニオン (O22-) を含むイオン性化合物です。過酸化ナトリウムの分子量は、反応物と生成物の量を決定するのに役立つため、化合物が関与する化学反応において重要です。
過酸化ナトリウムの構造
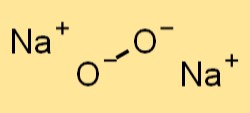
過酸化ナトリウムは、塩化ナトリウム (NaCl) に似た結晶構造を持っています。これは面心立方格子を形成し、ナトリウムイオンが立方体の隅を占め、過酸化物陰イオンが各面の中心に位置します。過酸化ナトリウム中の過酸化物アニオンは共有結合によって結合されており、ナトリウムイオンはイオン結合によって結合されています。
| 外観: | 白色〜黄色の粉末 |
| 比重: | 2,805g/cm3 |
| 色: | 白から黄色っぽい |
| 匂い: | 無臭 |
| モル質量: | 77.98g/モル |
| 密度: | 2,805g/cm3 |
| 融合点: | 675°C (1247°F) |
| 沸点: | 657°C (1215°F) |
| 引火点: | 適用できない |
| 水への溶解度: | 水と激しく反応する |
| 溶解度: | アルコール、エーテルに可溶 |
| 蒸気圧: | 適用できない |
| 蒸気密度: | 適用できない |
| pKa: | 適用できない |
| pH: | 適用できない |
過酸化ナトリウムの安全性と危険性
| 危険記号: | 酸化性、腐食性 |
| セキュリティの説明: | 粉塵、煙霧、ガス、ミスト、蒸気を吸い込まないでください。皮膚/目との接触を避けてください。不活性ガス下で取り扱い、保管してください。目に入った場合は、直ちに多量の水で洗い流し、医師の診察を受けてください。火災が発生した場合は、適切な消火剤を使用してください。 |
| 国連識別番号: | UN1503 |
| HSコード: | 2829.11.00 |
| 危険クラス: | 5.1 |
| 梱包グループ: | Ⅱ |
| 毒性: | 目や皮膚に対して腐食性があり、飲み込んだり吸入すると有害です。 |
過酸化ナトリウムの合成方法
過酸化ナトリウム (Na2O2) の合成は、直接結合、酸素との反応、電気分解などのいくつかの方法によって可能です。
Na2O2を合成する方法の一つに直接結合法があります。これには、炉内で金属ナトリウムを過剰な酸素とともに加熱することが含まれます。この反応は発熱を伴うため、過熱や爆発の可能性を避けるために温度を制御することが不可欠です。
別の方法では、水酸化ナトリウムと過酸化水素を反応させて Na2O2 と水を生成します。この方法は、直接混合する方法よりも安全で、より制御されていますが、より高い温度とより長い反応時間を必要とします。
Na2O2 を合成する別の方法は電気分解によるものです。これには、適切な陽極と陰極を使用した水酸化ナトリウム溶液の電気分解が含まれます。電気分解中、陰極は Na2O2 を生成し、陽極は酸素ガスを生成します。
過酸化ナトリウムの使用
過酸化ナトリウムは、その酸化特性と酸素を放出する能力により、さまざまな産業および実験室での用途に使用されています。
過酸化ナトリウムの一般的な用途は次のとおりです。
- 漂白剤: 紙パルプ、繊維およびその他の材料の漂白剤として使用されます。
- 消臭剤:廃棄物処理施設や排水処理施設の消臭剤として使用されます。
- 酸化剤: さまざまな有機および無機化合物を酸化するために使用されます。
- 重合: 特定のモノマーの重合を開始します。ポリウレタンフォームやその他のポリマーの製造に使用されます。
- 医薬用途: 医薬化合物の合成における試薬として使用されます。
- 実験用試薬: さまざまな分析および合成目的の実験用試薬として使用されます。
- 燃料電池の用途: 発電のために燃料電池の酸化剤として使用されます。
質問:
Q: 過酸化水素と亜硫酸水素ナトリウムの間の化学反応は何ですか?
A: 過酸化水素と亜硫酸水素ナトリウムの化学反応により、水と硫酸ナトリウムが生成されます。反応の平衡式は次のとおりです: 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O。
Q: 過酸化ナトリウム粉末はどこで購入できますか?
A: 過酸化ナトリウム粉末は、さまざまな化学物質の供給業者や販売業者から購入できます。サプライヤーが信頼できるものであり、危険な化学物質の取り扱いと輸送に関して適切な安全プロトコルに従っていることを確認することが重要です。
Q: 酸化ナトリウムから水素化ホウ素や過酸化水素を作ることはできますか?
A: 酸化ナトリウムは水素化ホウ素と過酸化水素から直接作ることはできません。酸化ナトリウムは、金属ナトリウムと酸素との反応、または水酸化ナトリウムの加熱によって合成できます。水素化ホウ素と過酸化水素は、酸化ナトリウムの合成には一般的に使用されません。
Q: 過酸化ナトリウムの式は何ですか?
A: 過酸化ナトリウムの式は Na2O2 です。
Q: Na2O2 の酸化状態は何ですか?
A: Na2O2 のナトリウムの酸化状態は +1、酸素の酸化状態は -1 です。
Q: 化合物 Na2O2 の酸素の酸化数は何ですか?
A: 化合物 Na2O2 の酸素の酸化数は -1 です。
