硫酸ニッケル (NiSO4) は、ニッケル、硫黄、酸素原子で構成される化合物です。これは、電気めっき、触媒、および一部の肥料の栄養素として一般的に使用されます。
| IUPAC名 | 硫酸ニッケル(II) |
| 分子式 | NiSO4 |
| CAS番号 | 7786-81-4 |
| 同義語 | 硫酸ニッケル、硫酸ニッケル塩、硫酸ニッケル(II)、ニッケル(2+);硫酸塩 |
| インチチ | InChI=1S/Ni・H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
硫酸ニッケルの性質
硫酸ニッケルの配合
硫酸ニッケルの化学式は NiSO4 です。ニッケル原子(Ni)と硫酸基(SO4)の組み合わせを表します。この式は、硫酸基に酸素だけでなく、ニッケルと硫黄が存在することを明確に示しています。
硫酸ニッケルのモル質量
硫酸ニッケル (NiSO4) のモル質量は、構成元素の原子質量を加算して計算されます。ニッケル (Ni) の原子量は 1 モルあたり約 58.69 グラムですが、硫黄 (S) の原子量は 1 モルあたり約 32.07 グラム、酸素 (O) の原子量は 1 モルあたり約 16 グラムです。これらの値を加算すると、硫酸ニッケルのモル質量は 1 モルあたり約 154.76 グラムと決定されます。
硫酸ニッケルの沸点
硫酸ニッケルは加熱すると分解するため、特定の沸点がありません。ただし、その分解温度は圧力や他の物質の存在などの要因によって影響されることに注意することが重要です。したがって、硫酸ニッケルを高温にさらす場合は注意して取り扱うことをお勧めします。
硫酸ニッケル 融点
硫酸ニッケルの融点は約摂氏 100 度 (華氏 212 度) です。この温度では、固体の硫酸ニッケルが液体の状態に変化します。硫酸ニッケルの純度や結晶構造の変動により、その融点がわずかに影響を受ける可能性があることは言及する価値があります。
硫酸ニッケルの密度 g/mL
硫酸ニッケルの密度は、単位体積あたりの質量を指します。硫酸ニッケルの密度は通常、1 ミリリットルあたり約 3.68 グラム (g/mL) です。密度はサンプルの温度と純度に応じて変化する可能性があることに注意してください。
硫酸ニッケルの分子量
硫酸ニッケル (NiSO4) の分子量は、構成元素の原子量の合計です。前述したように、硫酸ニッケルの分子量は 1 モルあたり約 154.76 グラムです。
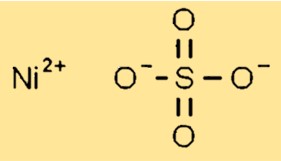
硫酸ニッケルの構造
硫酸ニッケルは固体状態では結晶構造を持っています。各ニッケル (Ni2+) イオンが硫酸基の 6 つの酸素原子に囲まれた単斜晶系結晶を形成します。硫酸基は、結晶格子を効率的に圧縮できるように配置されています。
硫酸ニッケルの溶解度
硫酸ニッケルは水に中程度の溶解度を持っています。水に容易に溶解し、温度が上昇すると溶解度が増加します。他のイオンや物質の存在は、その溶解度に影響を与える可能性があります。さらに、硫酸ニッケルは水分子と結合すると水和物を形成する可能性があり、さまざまな硫酸ニッケル水和物の形成につながります。
| 外観 | 青/緑の結晶 |
| 比重 | 3.68g/ml |
| 色 | ブルーグリーン |
| 匂い | 無臭 |
| モル質量 | 154.76 g/モル |
| 密度 | 3.68g/ml |
| 融合点 | 100°C (212°F) |
| 沸点 | 分解された |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | 水およびエタノールなどの有機溶媒に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | -1.1(硫酸) |
| pH | 酸(約4) |
硫酸ニッケルの安全性と危険性
硫酸ニッケルには、考慮する必要がある特定の安全上のリスクがあります。潜在的なリスクを避けるために、慎重に取り扱うことが重要です。皮膚の炎症や感作を引き起こす可能性があるため、皮膚への直接接触は最小限に抑える必要があります。硫酸ニッケルの摂取または吸入は、健康への悪影響を引き起こす可能性があるため避けてください。硫酸ニッケルを扱う場合は、物質との接触を避けるために手袋やゴーグルなどの適切な個人用保護具を着用する必要があります。硫酸ニッケルは、混触しない物質から離れた涼しく乾燥した場所に保管する必要があります。硫酸ニッケルを扱う場合は、浮遊粒子の濃度を最小限に抑えるために適切な換気が必要です。
| ハザードシンボル | なし |
| セキュリティの説明 | – 皮膚との接触を避ける – 摂取および吸入を避ける – 適切な個人用保護具を着用してください |
| 国連の識別子 | 適用できない |
| HSコード | 2833.25 |
| 危険等級 | 未分類 |
| 梱包グループ | 適用できない |
| 毒性 | 皮膚の炎症や感作を引き起こす可能性があります |
硫酸ニッケルの合成法
硫酸ニッケルを合成するにはさまざまな方法があります。
一般的なアプローチには、金属ニッケルまたは酸化ニッケルと硫酸との反応が含まれます。この方法では、硫酸が金属 Ni または酸化ニッケルを溶解し、硫酸ニッケルが形成されます。効率的な変換を確実にするために、温度や撹拌などの制御された条件下で反応を実行できます。
別の方法には、硫酸と炭酸ニッケルの反応が含まれます。硫酸は炭酸ニッケルを溶解し、硫酸ニッケルを生成します。化学者は通常、炭酸ニッケルが容易に入手できる場合にこの方法を使用します。炭酸ニッケルは出発原料として便利です。
さらに、硫酸は水酸化ニッケルを溶解して NiSO4 を合成します。水酸化ニッケルが硫酸に溶解すると、NiSO4 が生成します。この方法は、硫酸ニッケルの合成の前駆体として水酸化ニッケルを使用したい場合に適しています。
合成プロセス中は適切な安全上の注意事項に従う必要があることに注意することが重要です。これには、適切な保護具の使用と取り扱い手順が含まれます。有害な蒸気にさらされるリスクを最小限に抑えるため、反応は換気の良い場所で行ってください。最適な硫酸ニッケルの変換率と収率を確保するには、温度や濃度などの反応パラメータを注意深く制御することが重要です。
硫酸ニッケルの用途
硫酸ニッケルは、さまざまな業界でさまざまな用途に使用されます。一般的な用途のいくつかを次に示します。
- 電気めっき: 電気めっきプロセスでは、硫酸ニッケルを広範囲に使用して、金属表面に耐久性と耐食性のコーティングを作成します。硫酸ニッケルは、宝石、自動車部品、台所用品などのアイテムの外観、硬度、強度を向上させます。
- 触媒: 硫酸ニッケルは、水素化や酸化プロセスを含む多くの化学反応において触媒として機能します。業界では、医薬品、石油化学製品、ファインケミカルの製造に硫酸ニッケル触媒が使用されています。
- バッテリー: 充電式バッテリー、特に Ni-Cd および Ni-MH バッテリーには、必須成分として硫酸ニッケルが含まれています。硫酸ニッケルは電極反応を促進し、電気エネルギーの効率的な貯蔵と放出を保証します。
- 肥料: 一部の肥料は、植物に必須栄養素を提供するために硫酸ニッケルからの可溶性 Ni を使用します。ニッケルは植物のさまざまな代謝プロセスで重要な役割を果たし、植物の成長と発達に貢献します。
- 繊維: 繊維業界では、生地の色堅牢度と染料の吸収性を向上させるために、染色および印刷のプロセスで硫酸ニッケルを使用しています。硫酸ニッケルにより、鮮やかで長持ちする色の仕上がりが保証されます。
- 医薬品: 硫酸ニッケルは、主に有効成分として Ni を含む医薬品の製造、または医学研究で使用される特定の Ni 錯体の配合など、医薬品の調製に応用されています。
- 研究開発: 研究所では、化学合成、電気化学研究、材料科学研究など、さまざまな研究開発目的で硫酸ニッケルを使用しています。
質問:
Q: 硫酸ニッケル(II)の式は何ですか?
A: 硫酸ニッケル(II)の式はNiSO4です。
Q: 金属クロムを硫酸ニッケル(II)の溶液に添加します。バランスの取れた化学反応とは何ですか?
A: バランスの取れた化学反応は、Cr + NiSO4 -> CrSO4 + Ni です。
Q: 硫酸ニッケルアンモニウムはどのように作るのですか?
A: 硫酸ニッケルアンモニウムは、硫酸ニッケルと硫酸アンモニウムを水に溶解し、結晶化させることで調製できます。
Q: 硫酸ニッケルは水に溶けますか?
A: はい、硫酸ニッケルは水溶性です。
Q: 硫酸ニッケルを抽出するのは誰ですか?
A: 硫酸ニッケルは直接採掘されていません。ニッケル鉱石が採掘され、そこから硫酸ニッケルが生産されます。
Q: NiSO4 という化合物の名前は何ですか?
A: NiSO4 という化合物は硫酸ニッケルと呼ばれます。
Q: 水和物 100 g には NiSO4 が何グラム含まれていますか?モルは何個ですか?
A: 水和物 100 g 中の NiSO4 の量は、特定の水和化合物とそのモル質量によって異なります。
Q: NiSO4 は水に溶けますか?
A: はい、NiSO4 は水に溶けます。
Q: 収率が 76.9% の場合、NiSO4 は何グラム得られますか?
A: 得られる NiSO4 のグラム数は、初期量と反応条件によって異なります。
Q: NiSO4 は危険ですか?
A: NiSO4 は正しく扱わないと危険です。作業するときは安全上の注意事項に従うことが重要です。
Q: 共有結合化合物 NiSO4 の名前は何ですか?
A: NiSO4 は共有結合性化合物ではありません。硫酸ニッケルと呼ばれるイオン性化合物です。
Q: NiSO4 は塩ですか?
A: はい、NiSO4 は、そのイオン性と、酸 (硫酸) と塩基 (水酸化ニッケル) の反応によって形成されることから、塩とみなされます。
Q: NiSO4 の料金はいくらですか?
A: NiSO4 では、ニッケル イオン (Ni2+) は 2+ の正電荷を持ち、硫酸イオン (SO4 2-) は 2- の負電荷を持ちます。
