硝酸銅 (Cu(NO3)2) は、さまざまな産業で使用される青色の結晶性化合物です。化学プロセスにおいて銅材料の触媒、酸化剤、前駆体として機能します。
| IUPAC名 | 硝酸銅(II) |
| 分子式 | Cu(NO3)2 |
| CAS番号 | 3251-23-8 |
| 同義語 | 硝酸銅;硝酸銅;硝酸銅;硝酸、銅塩 (2+) |
| インチチ | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
硝酸銅の性質
硝酸銅の配合
硝酸銅の化学式は Cu(NO3)2 です。これは、各硝酸銅分子に 1 つの銅イオン (Cu) と 2 つの硝酸イオン (NO3) が含まれていることを示します。銅(II)イオンの存在は、銅の+2の酸化状態を示します。
硝酸銅のモル質量
硝酸第二銅のモル質量は、構成元素の原子量を加算することで計算できます。銅 (Cu) のモル質量は約 63.55 g/mol ですが、硝酸塩 (NO3) のモル質量は約 62.00 g/mol です。したがって、硝酸銅のモル質量は約 187.55 g/mol です。
硝酸銅の沸点
硝酸銅の沸点は、標準大気圧下で液体から気体に変化する温度を指します。硝酸銅の沸点は通常 100°C (212°F) を超えます。ただし、硝酸銅は通常、沸点に達する前に分解することに注意することが重要です。
硝酸銅の融点
硝酸銅の融点は、硝酸銅が固体から液体に変化する温度です。硝酸銅の融点は一般に 256°C ~ 260°C (493°F ~ 500°F) です。この物質は分解を避けるために注意して取り扱うことが重要です。
硝酸銅の密度 g/mL
硝酸銅の密度は、単位体積あたりの質量を指します。固体硝酸銅の密度は一般に約 2.32 g/mL ですが、その水溶液の密度は濃度に応じて変化します。
硝酸銅の分子量
硝酸銅の分子量は、その化学式に含まれるすべての原子の原子量の合計です。 Cu(NO3)2 の場合、分子量は約 187.55 g/mol です。
硝酸銅の構造
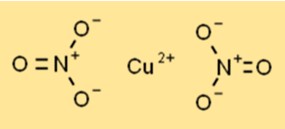
硝酸銅は、六方晶系の結晶構造を持つ青色の結晶固体として存在します。各銅イオン (Cu2+) は、2 つの硝酸イオンからの 6 つの酸素原子に囲まれ、調整された配置を作成します。この構造は、さまざまな化学プロセスにおける安定性と反応性に貢献します。
硝酸銅の溶解度
硝酸銅は水に中程度に溶けます。水に溶解すると水溶液を形成し、電気メッキや化学反応の試薬などのさまざまな用途に使用できます。ただし、温度が低くなると溶解度は低下します。
| 外観 | 青色の結晶固体 |
| 比重 | 該当なし |
| 色 | 青 |
| 匂い | 無臭 |
| モル質量 | 187.55 g/モル |
| 密度 | 2.32 g/mL (固体) |
| 融合点 | 256 ~ 260°C (493 ~ 500°F) |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 該当なし |
| 水への溶解度 | 中程度に溶解し、水溶液を形成する |
| 溶解性 | 水に溶ける |
| 蒸気圧 | 該当なし |
| 蒸気密度 | 該当なし |
| pKa | 該当なし |
| pH | 酸 |
硝酸銅の安全性と危険性
硝酸銅には安全性と危険性に関する一定の懸念があります。この化合物を慎重に取り扱うことが不可欠です。皮膚や目に直接触れると、炎症や火傷を引き起こす可能性があります。粉塵や煙を吸入すると、呼吸器官への炎症を引き起こす可能性があります。加熱すると有毒な窒素酸化物を放出する可能性があります。この物質は酸化剤でもあり、可燃性物質と接触すると発火する可能性がある。硝酸銅を扱う場合は、手袋やゴーグルなどの適切な保護具を着用する必要があります。潜在的なリスクを最小限に抑えるために、可燃性物質や不適合物質から離して保管する必要があります。常に安全上の注意事項に従い、換気の良い場所で使用してください。
| ハザードシンボル | 酸化剤、腐食性、刺激性 |
| セキュリティの説明 | デポジット付きで対応します。皮膚や目との接触を避けてください。換気の良い場所で使用してください。可燃物から遠ざけてください。 |
| 国連識別番号 | UN3085 |
| HSコード | 28342910 |
| 危険等級 | 5.1 (酸化剤) |
| 梱包グループ | Ⅲ |
| 毒性 | 飲み込むと有害。皮膚や目に炎症を引き起こす可能性があります。粉塵や煙を吸入すると、呼吸器官への炎症を引き起こす可能性があります。 |
硝酸銅の合成法
硝酸銅を合成するにはいくつかの方法があります。
一般的なアプローチには、酸化銅 (CuO) または水酸化銅 (Cu(OH)2) と硝酸 (HNO3)との反応が含まれます。硝酸第二銅を調製する場合、酸化第二銅または水酸化第二銅を硝酸溶液にゆっくりと添加すると、硝酸第二銅と水が生成します。
別の方法には、金属銅 (Cu) と濃硝酸の反応が含まれます。金属 Cu は硝酸と反応して、硝酸銅、二酸化窒素 (NO2)、および水を生成します。この方法では有毒な二酸化窒素ガスが発生するため、慎重な取り扱いが必要です。
あるいは、金属銅または酸化第二銅を硝酸と過酸化水素 (H2O2) の混合物に溶解して硝酸第二銅を生成することもできます。この方法により、より迅速な反応が可能になり、純粋な硝酸銅が生成されます。
最後に、 CuSO4と硝酸ナトリウム (NaNO3) の間の二重置換反応でも硝酸第二銅が生成されます。これら 2 つの塩を水に混合すると、硝酸銅が沈殿し、副生成物の硫酸ナトリウムは溶解したままになります。
含まれる化学物質は反応性を示すため、合成中は安全上の注意事項に従ってください。硝酸銅の合成を確実かつ安全に成功させるために、適切な保護具を使用し、適切な実験室での実践を行ってください。
硝酸銅の用途
硝酸銅は、その独特の特性により、さまざまな産業でさまざまな用途に使用されています。注目すべき用途には次のようなものがあります。
- 触媒: 有機合成において触媒として作用し、アルコールからアルデヒドやケトンへの変換などの反応を促進します。
- 火工品: 硝酸銅は火工品の配合の重要な成分であり、炎の青と緑の色に寄与します。
- 農業: 農業では、植物に必須の栄養素を提供する肥料中の銅の供給源として機能します。
- 酸化剤: 硝酸銅は、化学プロセス中に他の物質を積極的に酸化します。
- 金属めっき: 硝酸銅は、電気めっきプロセス中にさまざまな金属表面に Cu の薄層を積極的に堆積します。
- 顔料と染料: 硝酸銅は、セラミック、ガラス、繊維用の緑と青の顔料の生成に積極的に貢献します。
- 写真プロセス: 硝酸銅は、特定の写真溶液の画像現像に積極的に貢献します。
- 保存: 防腐剤の固定を助けることで木材の保存に応用されます。
- 他の銅化合物の調製: さまざまな銅ベースの材料および化合物の合成の前駆体として機能します。
硝酸銅の多用途性と反応性により、硝酸銅は工業プロセスから芸術的用途に至るまで、さまざまな分野で貴重な化学物質となっています。
質問:
Q: 硝酸銅を加熱するとどうなりますか?
A: 硝酸第二銅は加熱すると酸化第二銅、二酸化窒素ガス、酸素に分解します。
Q: 硝酸銅は水に溶けますか?
A: はい、硝酸銅は水に適度に溶けます。
Q: 硝酸銅の化学式は何ですか?
A: 硝酸銅の化学式は Cu(NO3)2 です。
Q: 硝酸銅は強電解質ですか?
A: はい、硝酸銅は強力な電解質であり、水に溶解するとイオンに解離します。
Q: 硝酸銅の電荷は何ですか?
A: 硝酸銅の正味電荷は 0 です。それは中性の化合物です。
Q: 硝酸銅(II) 10.2 g には窒素原子が何個含まれていますか?
A: 硝酸第二銅(II)が約 0.161 モル存在するため、窒素原子が約 0.322 モル存在します。
Q: 3.00 モルの銅と 3.85 モルの硝酸銀からどれくらいの銀が生成できますか?
A: 平衡化学式に従って、342.3 g の銀を生成できます。
Q: 硝酸銅は溶けますか?
A: はい、硝酸銅は水に溶けます。
Q: 硝酸銅(II)の式は何ですか?
A: 硝酸第二銅(II)の式はCu(NO3)2です。
Q: Cu(NO3)2 と Zn の置換反応では何が生成されますか?
A:置換反応では硝酸亜鉛(Zn(NO3)2)や金属第二銅(Cu)が生成されます。
Q:Cu(NO3)2とは何ですか?
A: Cu(NO3)2 は、青色の結晶性化合物である硝酸銅の化学式です。
Q: 次の反応で還元されるのはどれですか? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
A: 銅 (Cu) は反応中に還元され、電子を獲得して金属銅を形成します。
Q: 0.075 g の KOH を 1.0 × 10-3 M の Cu(NO3)2 1.0 L に溶解すると、固体の Cu(OH)2 が生成しますか?
A: いいえ、Cu(NO3)2 は溶液中で完全にイオン化し、KOH から過剰な OH- イオンが存在するため、固体の Cu(OH)2 は形成されません。
