硝酸銀 (AgNO3) は、銀、窒素、酸素から構成される化合物です。写真、医学、さまざまな反応の実験用試薬として一般的に使用されています。
| IUPAC名 | 硝酸銀 |
| 分子式 | 硝酸銀 |
| CAS番号 | 7761-88-8 |
| 同義語 | 一硝酸銀、硝酸銀(1+)塩、硝酸銀(I) |
| インチチ | InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
硝酸銀の性質
硝酸銀配合
一硝酸銀の化学式は AgNO3 です。 1 つの銀原子 (Ag)、1 つの窒素原子 (N)、および 3 つの酸素原子 (O) で構成されています。この式は一硝酸銀の分子内の原子の比率を表します。
硝酸銀モル質量
一硝酸銀のモル質量は、その構成元素の原子質量を加算することによって計算されます。銀の原子質量は 107.87 g/mol、窒素の質量は 14.01 g/mol、各酸素原子の質量は 16.00 g/mol です。それらを加えると、一硝酸銀のモル質量は約 169.87 g/mol になります。
硝酸銀の沸点
一硝酸銀の沸点は約摂氏 440 度 (華氏 824 度) です。この温度で、化合物は液体状態から気体状態に相転移します。沸点は、物質の蒸気圧が大気圧と等しくなる温度を示します。
硝酸銀 融点
一硝酸銀の融点は約摂氏 209 度 (華氏 408 度) です。これは、固体の一硝酸銀が液体に変わる温度です。融点は物質の特徴的な特性であり、さまざまな条件下での物理的挙動を決定するのに役立ちます。
硝酸銀の密度 g/mL
一硝酸銀の密度は約 4.35 g/mL です。密度は、特定の体積に含まれる質量の量の尺度です。物質の質量を体積で割ることによって計算されます。一硝酸銀の密度は、それが特定の空間内でどれだけ緻密であるか、またはどれだけ集中しているかを示します。
硝酸銀の分子量
一硝酸銀の分子量はモル質量とも呼ばれ、約 169.87 g/mol です。これは、一硝酸銀の分子内のすべての原子の原子質量の合計を表します。分子量は、化合物の量に関するさまざまな計算や変換に使用されます。
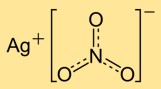
硝酸銀の構造
一硝酸銀は、銀カチオン (Ag+) と硝酸アニオン (NO3-) で構成される結晶構造を持っています。銀イオンは硝酸イオンに囲まれ、規則的なネットワークを形成しています。このイオン構造は、化合物の安定性と特性に寄与します。
硝酸銀の溶解度
一硝酸銀は水に非常に溶けます。水に容易に溶解し、無色透明の溶液を形成します。一硝酸銀の水への溶解度は重要な特性であり、医療、写真、化学反応などのさまざまな用途で重要な役割を果たします。
| 外観 | 白色の結晶固体 |
| 比重 | 4.35g/ml |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 169.87 g/モル |
| 密度 | 4.35g/ml |
| 融合点 | 209°C (408°F) |
| 沸点 | 440°C (824°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 可溶性 |
| 溶解性 | 水およびエタノールなどの有機溶媒に可溶 |
| 蒸気圧 | 25°C (77°F) で 0.26 mmHg |
| 蒸気密度 | 適用できない |
| pKa | – |
| pH | 酸性 (水溶液では約 pH 5 ~ 6) |
硝酸銀の安全性と危険性
一硝酸銀には安全上のリスクがいくつかあるため、化合物を取り扱う際には注意が必要です。摂取、吸入、または皮膚や目に接触した場合は有害であると考えられています。手袋、安全メガネ、白衣などの保護手段を使用する必要があります。皮膚やその他の表面に炎症、火傷、シミを引き起こす可能性があります。加熱すると有毒な窒素酸化物を放出する可能性があります。不適合物質から離れた涼しく乾燥した場所に保管する必要があります。環境の汚染を避けるために、流出物は速やかに清掃し、廃棄物処理は適切なガイドラインに従って行う必要があります。
| ハザードシンボル | 腐食性、酸化性 |
| セキュリティの説明 | 重度の皮膚火傷や目の損傷を引き起こします。 |
| 国連の識別子 | UN 1493 (固体一硝酸銀) |
| HSコード | 2843.10.00 |
| 危険等級 | クラス 5.1 (酸化性物質) |
| 梱包グループ | GE II(中級) |
| 毒性 | 水生生物に対して有毒であり、長期的な影響を及ぼします。 |
硝酸銀の合成法
一硝酸銀を合成するにはさまざまな方法があります。
一般的な方法には、金属銀と硝酸の反応が含まれます。このプロセスでは、希硝酸が銀を溶解して一硝酸銀を生成します。別の方法では、酸化銀または炭酸銀と硝酸を反応させ、一硝酸銀を生成します。
さらに、塩化銀と硝酸の反応でも一硝酸銀が生成されることがあります。硝酸は塩化銀を溶解し、塩化物イオンを置き換えて一硝酸銀を形成します。
さらに、硫酸銀と硝酸ナトリウムなどの可溶性硝酸塩との反応により、一硝酸銀が得られます。硫酸銀は水溶液中で硝酸塩と反応し、一硝酸銀と可溶性硫酸塩が形成されます。
これらの合成方法を実行する場合は、適切な安全対策を講じ、腐食性の酸や潜在的に有毒な化合物を使用することが重要です。一硝酸銀の正確な調製と取り扱いを保証するために、実験室のプロトコルとガイドラインにも従う必要があります。
硝酸銀の用途
一硝酸銀はさまざまな分野で多くの用途があります。一般的なアプリケーションをいくつか示します。
- 写真: 従来の白黒写真では、光と反応して銀粒子を形成し、写真画像を現像する感光性化合物として一硝酸銀が使用されています。
- 医療: 医療用途では、創傷ケアにおける消毒特性のために一硝酸銀が使用されています。局所に塗布すると、感染症を予防し、治癒を促進し、火傷、潰瘍、その他の皮膚の傷を治療します。
- 実験用試薬: 一硝酸銀は多用途の実験用試薬として機能し、さまざまな化学反応を可能にし、分析化学でハロゲン化物やその他の化合物の存在を検出するために使用されます。
- 銀メッキ: 電気メッキプロセスでは、一硝酸銀を使用して、さまざまな表面に銀の薄い層を積極的に堆積させます。この用途は、装飾目的と耐食性を提供するために一般的です。
- 染色と染色: 組織学と顕微鏡検査では、生体サンプル内の特定の構造の可視性を積極的に向上させるために、染料として一硝酸銀が使用されます。繊維産業では布地の染色に使用されています。
- 彫刻: 一硝酸銀は腐食性があるため、ガラスや鏡のパターンのエッチングに積極的に使用できます。表面層を選択的に除去し、複雑なパターンを作成します。
- 化学教育: 教育機関では、その独特の反応と視覚効果により、一硝酸銀を化学実験やデモンストレーションに積極的に使用しています。
- 銀触媒: 一部の化学反応では、一硝酸銀が触媒として積極的に作用し、反応物質から目的の生成物への変換を促進します。
質問:
Q: AgNO3 は水に溶けますか?
A: はい、AgNO3 は水に溶けます。
Q:AgNO3とは何ですか?
A: AgNO3 は一硝酸銀であり、銀、窒素、酸素から構成される化合物です。
Q: KCl(aq) と AgNO3(aq) の反応におけるスペクテーター イオンは何ですか?
A: KCl(aq) と AgNO3(aq) の反応では、スペクテイター イオンは K+ と NO3- です。
Q: AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq) の反応において、スペクテイター イオンがある場合、どのイオンが該当しますか?
A: AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq) の反応では、スペクテイター イオンは Na+ と NO3- です。
Q: 5.8 モルの AgNO3 と反応するには何モルの Cu が必要ですか?
A: 5.8 モルの AgNO3 と反応するのに必要な Cu のモル数を決定するには、バランスの取れた方程式が必要です。
Q: 次の化合物のうち、AgNO3 で沈殿物を生成するのはどれですか?
A: Cl-、Br-、または I- イオンを含む化合物は、AgNO3 とともに沈殿物を生成します。
Q: AgNO3 はイオン性化合物ですか?
A: はい、AgNO3 はイオン性化合物です。
Q: AgNO3 は強力な電解質ですか?
A: はい、AgNO3 は強力な電解質です。
Q: AgNO3 は電気を通しますか?
A: はい、AgNO3 は水に溶けると電気を伝導します。
Q: 硝酸銀は塩ですか?
A: はい、一硝酸銀は塩です。
Q: 硝酸銀を購入できますか?
A: はい、一硝酸銀は市販されています。
Q: 硝酸銀は溶液ですか?
A: 一硝酸銀は、その状態に応じて、固体の形で存在することも、溶液の形で存在することもできます。
Q: 硝酸銀の汚れを落とすにはどうすればよいですか?
A: 一硝酸銀の汚れは、過酸化水素やチオ硫酸ナトリウムなどの穏やかな還元剤で患部を処理することで除去できます。
Q: 硝酸銀は水に溶けますか?
A: はい、一硝酸銀は水溶性です。
Q: 硝酸銀とクロム酸カリウムの溶液を混合すると、どのような沈殿が形成されますか?
A: 一硝酸銀とクロム酸カリウムの溶液を混合すると、クロム酸銀 (Ag2CrO4) の黄色の沈殿物が形成されます。
Q: 硝酸銀のモル質量はどれくらいですか?
A: 一硝酸銀 (AgNO3) のモル質量は約 169.87 g/mol です。
Q: 金属銀を硝酸鉛(II)の溶液に添加します。バランスの取れた化学反応とは何ですか?
A: バランスの取れた化学反応は 2Ag + Pb(NO3)2 → 2AgNO3 + Pb です。
