硝酸カリウム (KNO3) は、肥料、食品保存、花火などによく使用される白色の結晶塩です。また、敏感な歯用の一部の歯磨き粉の重要な成分でもあります。
| IUPAC名 | 硝酸カリウム |
| 分子式 | KNO3 |
| CAS番号 | 7757-79-1 |
| 同義語 | 硝石;カリの硝酸塩。硝石;硝石; E252;中国硝石。硝酸、カリウム塩;カリイのニトラ |
| インチチ | InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
硝酸カリウムの性質
硝酸カリウムの配合
硝酸カリウムの化学式は KNO3 です。この式は、化合物が 1 つのカリウム イオン、1 つの硝酸イオン、および 3 つの酸素イオンで構成されていることを示しています。この式は、反応に必要な硝酸カリウムの量を計算したり、化合物中に存在する元素やイオンを特定したりするのに役立ちます。
硝酸カリウムのモル質量
KNO3 のモル質量は 101.1 g/mol です。モル質量は物質 1 モルの質量であり、化合物内のすべての原子の原子質量を加算することによって計算されます。 KNO3 の場合、モル質量は 1 個のカリウム原子、1 個の窒素原子、および 3 個の酸素原子の原子量を加算することによって計算されます。この値は、反応に必要な KNO3 の量を決定したり、濃度などの他の特性を計算したりするのに役立ちます。
硝酸カリウムの沸点
KNO3 は 1.336 °C (2.437 °F) と比較的高い沸点を持っています。これは、化合物の原子間の結合を破壊し、液体から気体に変換するには多量のエネルギーが必要であることを意味します。この特性により、KNO3 は花火の製造など、高温反応が必要な用途に役立ちます。
硝酸カリウムの融点
KNO3 の融点は 334°C (633°F) です。これは、334°C を超える温度では、KNO3 が固体から液体に変化することを意味します。この特性により、KNO3 はガラス製造などの用途で役立ち、シリカの融点を下げるフラックスとして使用されます。
硝酸カリウムの密度 g/mL
KNO3 の密度は室温で 2.109 g/mL です。密度は、物質の単位体積あたりの質量の尺度です。 KNO3 の密度は、窒素とカリウムの供給源として使用される肥料生産などの用途において重要です。密度は、所定の体積の溶液に必要な KNO3 の量を決定するのにも役立ちます。
硝酸カリウムの分子量
KNO3 の分子量は 101.1 g/mol です。この値は、化合物内のすべての原子の原子量を加算することによって計算されます。分子量は、反応に必要な KNO3 の量や溶液の濃度など、KNO3 の他の特性を計算するのに役立ちます。
硝酸カリウムの構造
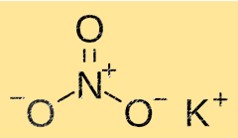
KNO3 は、カリウム、硝酸イオン、酸素イオンから構成される結晶構造を持っています。カリウムイオンは 6 つの硝酸イオンに囲まれており、硝酸イオンは 6 つのカリウムイオンに囲まれています。この構造により、KNO3 に溶解度、融点、密度などの特徴的な特性が与えられます。
| 外観 | 白色の結晶性粉末 |
| 比重 | 2.109 g/cm3 (20°C) |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 101.1032 g/モル |
| 密度 | 2.109 g/cm3 |
| 融合点 | 334°C (633°F) |
| 沸点 | 400°C (752°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 133 g/L(20℃) |
| 溶解性 | グリセロール、アンモニア、水に可溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | 4.75 |
| pH | 6.9 – 7.3 |
硝酸カリウムの安全性と危険性
KNO3 は正しく取り扱われれば比較的安全ですが、不適切に取り扱われると危険を引き起こす可能性があります。これは酸化剤として分類されており、他の物質の燃焼を促進する可能性があります。 KNO3 は目、皮膚、気道を刺激する可能性があり、大量に摂取または吸入すると有毒になる可能性があります。 KNO3 を取り扱うときは、手袋、ゴーグル、呼吸用保護具などの保護具を着用し、可燃性物質から離れた涼しく乾燥した場所に保管することが重要です。環境の汚染を避けるために、適切な廃棄方法にも従う必要があります。
| ハザードシンボル | ああ、Xn |
| セキュリティの説明 | 熱/火花/裸火/高温の表面から遠ざけてください。保護手袋/目の保護具/顔の保護具を着用してください。飲み込んだ場合: 気分が悪くなった場合は、中毒センター/医師に連絡してください。口をすすいでください。嘔吐を誘発しないでください。吸入した場合: 傷病者を新鮮な空気の場所に移し、呼吸しやすい姿勢で休ませてください。中毒センター/医師に連絡してください。 |
| 国連識別番号 | 1486年 |
| HSコード | 2834.21.00 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅲ |
| 毒性 | 吸入すると呼吸器への刺激、咳、息切れを引き起こす可能性があります。目や皮膚の炎症を引き起こす可能性があります。経口摂取すると、腹痛、吐き気、嘔吐、下痢を引き起こす可能性があります。大量に飲み込んだり吸入すると有毒となる可能性があります。 |
硝酸カリウムの合成法
KNO3 はいくつかの方法で合成できます。
一般的な方法は、水酸化カリウムと硝酸の反応です。反応容器は 2 つの物質を混合し、通常は約 80°C の高温に加熱します。その後、混合物は冷却され、濾過プロセスにより固体の KNO3 が回収されます。
別の方法は、塩化カリウムと硝酸ナトリウムの反応です。反応容器内で 2 つの物質を混合し、通常は約 600°C の高温に加熱します。
得られた混合物は溶けてから固化し、KNO3 結晶が形成されます。
3 番目の方法には、触媒の存在下で硝酸によるアンモニアの酸化が含まれます。この方法はより複雑で、一般に工業規模で使用されます。
KNO3 は、洞窟や地下堆積物などの自然源から抽出できます。ただし、この方法は収率が低く、抽出された KNO3 に不純物が含まれるため、あまり一般的ではありません。
硝酸カリウムの用途
KNO3 はその化学的特性により、さまざまな産業で幅広い用途に使用されています。 KNO3 の一般的な使用法をいくつか示します。
- 肥料 – 窒素とカリウムの含有量が高いため、肥料として使用されます。果物、野菜、タバコなど、高レベルのカリウムを必要とする作物に特に役立ちます。
- 食品の保存 – 特に塩漬け肉の食品保存料としても使用されます。細菌の増殖を抑制し、腐敗を防ぎ、製品の保存期間を延ばします。
- 花火 – 花火やその他の花火装置の製造において重要な要素です。それは酸化剤として作用し、他の物質の燃焼を促進する酸素を生成します。
- 歯磨き粉 – 歯の知覚過敏を軽減するために一部の歯磨き粉に添加されています。歯の神経から脳への痛みの信号の伝達をブロックすることで作用します。
- 薬用用途 – 利尿作用と去痰作用があるため薬用に使用されます。狭心症や高血圧の治療にも使用します。
- 産業用途 – ガラス、セラミック、染料の製造など、さまざまな産業用途でも使用されます。
質問:
Q: 硝酸カリウムは水に溶けますか?
A: はい、KNO3 は水によく溶けます。室温では、100 グラムの水に約 37 グラムの KNO3 が溶解します。
Q: 硝酸カリウムは何に使用されますか?
A: KNO3 は、肥料、食品保存料、火工品酸化剤、歯磨き粉の原料、ガラス、セラミック、染料の製造の成分など、さまざまな目的に使用されています。
Q: 硝酸カリウムとは何ですか?
A: 硝酸カリウムは硝石としても知られ、化学式 KNO3 で表される化合物です。カリウムイオン(K+)と硝酸イオン(NO3-)から構成されるイオン性塩です。
Q: 硝酸カリウムを中和するものは何ですか?
A: カルシウムとマグネシウムのイオンは、植物における過剰な KNO3 の有害な影響を打ち消すことができます。人間の場合、KNO3 中毒に対する既知の解毒剤はなく、治療が非常に役立ちます。
Q: kno3 は水に溶けますか?
A: はい、KNO3 は水によく溶けます。
Q:低濃度kno3を含む水の電気分解生成物とは何ですか?
A: 低濃度の KNO3 を含む水の電気分解生成物は、水素ガス (H2) と酸素ガス (O2) です。
Q:kno3とは何ですか?
A: KNO3 は硝酸カリウムの化学式であり、硝石としても知られています。
Q: kno3 の個々の窒素原子の酸化状態は何ですか?
A: KNO3 では、各窒素原子の酸化状態は +5 です。
Q: kno3 は酸ですか、それとも塩基ですか?
A: KNO3 は酸でも塩基でもありません。これは、カチオン (K+) とアニオン (NO3-) から構成される塩です。
