炭酸マグネシウム (MgCO3) は、制酸薬や下剤として一般的に使用される白色の粉末状の物質です。特定の化粧品や歯磨き粉にも含まれています。炭酸マグネシウムは過剰な胃酸を中和し、便秘を解消するのに役立ちます。
| IUPACの名称 | 炭酸マグネシウム |
| 分子式 | MgCO3 |
| CAS番号 | 546-93-0 |
| 同義語 | マグネサイト、マグネシアカーボニカ、マグネシウム塩、(MgCO3) |
| インチチ | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
炭酸マグネシウムの性質
炭酸マグネシウムの配合
炭酸マグネシウムの化学式はMgCO3です。この式は、炭酸マグネシウムには 1 つの Mg+2 イオンと 1 つの CO3 2- イオンが含まれていることを示します。 CO3 2-イオンは 1 つの C 原子と 3 つの O 原子で構成されています。炭酸マグネシウムの化学式は、炭酸マグネシウムの組成とその構成元素を特定するため、重要な特性です。
炭酸マグネシウムのモル質量
MgCO3 のモル質量は 84.31 g/mol です。この値は、1 モルの MgCO3 中のマグネシウム、炭素、酸素原子の原子量を加算することによって得られます。モル質量は、特定のサンプル中の MgCO3 のモル数の決定など、さまざまな計算に使用されるため、MgCO3 の重要な物理的特性です。
炭酸マグネシウムの沸点
MgCO3 は沸点に達する前に分解するため、定義された沸点がありません。加熱すると、MgCO3 が分解して酸化マグネシウムと二酸化炭素が生成します。 MgCO3 の分解は約 350°C の温度で起こります。
炭酸マグネシウム 融点
MgCO3の融点は990℃です。この温度で、MgCO3 は溶けて分解し、酸化マグネシウムと二酸化炭素を形成します。 MgCO3 の融点は、MgCO3 を融解して処理できる温度を決定するため、重要な物理的特性です。
炭酸マグネシウムの密度 g/mL
MgCO3 の密度は 2.958 g/mL です。この値は、1 モルの MgCO3 の質量をその体積で割ることによって得られます。 MgCO3 の密度は、特定の溶液中の MgCO3 の浮力の決定など、さまざまな用途に使用されるため、重要な物理的特性です。
炭酸マグネシウムの分子量
MgCO3 の分子量は 84.31 g/mol です。この値は、MgCO3 分子内のマグネシウム、炭素、酸素原子の原子量を加算することによって得られます。 MgCO3 の分子量は、特定の化学反応に必要な MgCO3 の量の決定など、さまざまな計算に使用されるため、重要な物理的特性です。
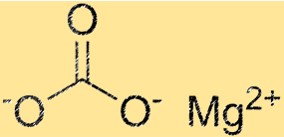
炭酸マグネシウムの構造
MgCO3 は三方晶系の結晶構造を持っています。マグネシウムイオンは構造の中心に位置し、6つの炭酸イオンに囲まれています。炭酸イオンはマグネシウムイオンの周りに六角形のパターンで配置されます。 MgCO3 の結晶構造は、その物理的および化学的特性を決定するため、重要な特性です。
| 外観 | 白色固体 |
| 比重 | 2,958g/ml |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 84.31 g/モル |
| 密度 | 2,958g/ml |
| 融合点 | 990℃ |
| 沸点 | 沸点に達する前に分解する |
| フラッシュドット | 適用できない |
| 水への溶解度 | 0.02g/L(15℃) |
| 溶解性 | 酸に可溶、水に不溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 10.3 |
| pH | 9.2-10.2 |
炭酸マグネシウムの安全性と危険性
MgCO3 は安全な化合物であると考えられています。引火性、爆発性、有毒性はありません。ただし、他の化合物と同様に、慎重に取り扱う必要があります。 MgCO3 粉塵を吸入すると、呼吸器官への炎症を引き起こす可能性があります。 MgCO3 を取り扱う場合は、手袋や安全メガネなどの適切な個人用保護具を着用することをお勧めします。 MgCO3 は、熱源や発火源から離れた、涼しく乾燥した場所に保管する必要があります。こぼれた MgCO3 はすぐに掃除し、適切に処分する必要があります。 MgCO3 を取り扱う際は、潜在的な危険を避けるために適切な安全上の注意事項に従うことが重要です。
| ハザードシンボル | なし |
| セキュリティの説明 | 危険物として分類されていない |
| 国連識別番号 | 適用できない |
| HSコード | 2836.60.00 |
| 危険等級 | 危険物として分類されていない |
| 梱包グループ | 適用できない |
| 毒性 | 毒性が低く、適切に取り扱われれば重大な健康リスクとは考えられません。 |
炭酸マグネシウムの合成法
MgCO3 を合成するには、沈殿法や熱分解法など、いくつかの方法があります。
沈殿法を使用して MgCO3 を形成するには、可溶性マグネシウム塩 (塩化マグネシウムや硝酸マグネシウムなど) を可溶性炭酸塩 (炭酸ナトリウムや硝酸マグネシウムなど) を含む溶液に加えます。炭酸アンモニウム)。次に、得られた混合物をかき混ぜて放置します。これにより、MgCO3 が溶液から沈殿します。その後、沈殿を濾過し、洗浄し、乾燥させます。
熱分解法でMgCO3を得るには、水酸化マグネシウムまたは酸化マグネシウムを二酸化炭素を導入しながら加熱します。この反応により、MgCO3 と水蒸気が生成されます。次のステップは、MgCO3 を収集、精製、乾燥することです。
MgCO3 を合成する別の方法は、硫酸マグネシウムと炭酸ナトリウムを反応させることです。水は 2 つの化合物を溶解して混合し、溶液から MgCO3 を沈殿させます。次に、沈殿物を収集し、洗浄し、乾燥させます。
炭酸マグネシウムの用途
MgCO3 は、さまざまな業界でさまざまな用途に使用される多用途の化合物です。その用途の一部を次に示します。
- 栄養補助食品: 体に必須のマグネシウムを提供する能力があるため、栄養補助食品として使用されます。
- 制酸剤: 胸焼けや消化不良を治療するための制酸剤として使用されます。
- 産業用途: セラミック、ガラス、セメントの製造など、いくつかの産業用途で使用されます。
- 化粧品: 膨潤剤、吸収剤、不透明剤として化粧品に使用されます。
- 難燃剤: 断熱材、繊維、プラスチックなどのさまざまな用途で難燃剤として使用されます。
- 医薬品: 下剤や制酸薬などのさまざまな医薬品の製造に使用されます。
- 食品産業: 食品の酸性度を調整するための食品添加物および固結防止剤として使用されます。
- スポーツ用品:ジムチョークなどのスポーツ用品に使用され、グリップ力の向上と滑り防止に使用されます。
質問:
Q: 炭酸マグネシウムは水に溶けますか?
A: MgCO3 は水への溶解度が低いです。室温では、100 ml の水に約 0.02 グラムの MgCO3 しか溶解できません。
Q: MgCO3 は水溶性ですか?
A: MgCO3 は水への溶解度が低いため、あまり溶けません。
Q: 酢酸と MgCO3 が反応すると何が生成しますか?
A: 酢酸と MgCO3 が反応すると、酢酸マグネシウム、水、二酸化炭素が生成されます。この反応の平衡化学方程式は、MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2 です。
Q: MgCO3 のモル溶解度は 1.8 × 10-4 mol/L です。この化合物の Ksp は何ですか?
A: モル溶解度を使用した MgCO3 の Ksp 値:
Ksp = [Mg2+][CO32-]、ここで、[Mg2+] はモル溶解度に等しく、[CO32-] もモル溶解度に等しい。したがって、Ksp = (1.8 × 10−4 mol/L)2 = 3.24 × 10−9 となります。
Q: MgCO3 の分解中に生成される生成物は次のうちどれですか?
A: MgCO3 が分解すると、酸化マグネシウム (MgO) と二酸化炭素 (CO2) が生成されます。
Q: MgCO3(s) の ΔH°f を計算するために使用される反応の平衡化学方程式は何ですか?
A: MgCO3(s) の標準生成エンタルピー (ΔH°f) を計算するために使用される反応の平衡化学方程式は、Mg(s) + CO2(g) → MgCO3(s) です。
