炭化カルシウムは、化学式 CaC2 で表される化合物です。主にアセチレンガスとカルシウムシアナミドの製造に使用されます。水と反応してアセチレンガスと水酸化カルシウムを生成します。人々はそれを溶接や照明に使用します。
| IUPACの名称 | カルシウムエチンジド |
| 分子式 | CaC2 |
| CAS番号 | 75-20-7 |
| 同義語 | カルシウムアセチリド、過炭素カルシウム、二炭化カルシウム、カルブロカルシウム、カルブロカルシコ、エチンジドカルシウム |
| インチチ | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
炭化カルシウムの性質
炭化カルシウム配合
炭化カルシウムの化学式は CaC2 です。これは、炭化カルシウム分子が 1 つのカルシウム原子と 2 つの炭素原子で構成されていることを意味します。式は化合物の元素の比率を示しています。
炭化カルシウムのモル質量
CaC2 のモル質量は 64.099 g/mol です。これは、1 モルの CaC2 の質量が 64,099 グラムであることを意味します。モル質量は、式内の元素の原子質量を加算することによって計算されます。カルシウムの原子量は 40.078 g/mol、炭素の原子量は 12.011 g/mol です。
炭化カルシウムの沸点
CaC2の沸点は2300℃です。これは、この温度で CaC2 が液体から気体に変化することを意味します。沸点は分子間力と大気圧の影響を受けます。 CaC2 は強いイオン結合を持っており、切断するには多くのエネルギーが必要です。
炭化カルシウム 融点
CaC2の融点は2160℃です。これは、CaC2 がこの温度で固体から液体に変化することを意味します。融点は分子間力や大気圧にも影響されます。 CaC2 は、強いイオン結合により融点が高くなります。
炭化カルシウムの密度 g/ml
CaC2 の密度は 2.22 g/ml です。これは、1 ミリリットルの CaC2 の質量が 2.22 グラムであることを意味します。密度は質量を体積で割ることによって計算されます。密度は、物質内の原子または分子の構成と配置に依存します。 CaC2 は、その原子が結晶構造内に密に詰まっているため、密度が高くなります。
炭化カルシウムの分子量
CaC2 の分子量は 64,099 amu (原子質量単位) です。これは、CaC2 分子の質量が 64,099 amu であることを意味します。分子量は、式内の元素の原子量にそれぞれの原子数を乗算して計算されます。カルシウムの原子量は 40.078 amu、炭素の原子量は 12.011 amu です。
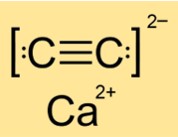
炭化カルシウムの構造
CaC2 の構造は、相 (I、II、または III) に応じて、正方晶、単斜晶、または単斜晶です。これは、CaC2 の原子や分子の形状や配置が、状態や条件によって異なることを意味します。構造は物質の対称性と幾何学的形状によって決まります。 CaC2 は、I 相では正方晶系構造、II 相では単斜晶系構造、III 相では別の単斜晶系構造をとります。
炭化カルシウムの溶解度
CaC2 の溶解度は、水中では急速に加水分解されます。これは、CaC2 が水と迅速に反応し、生成物としてアセチレンガスと水酸化カルシウムを生成することを意味します。溶解度は、特定の温度および圧力で特定の溶媒に溶解できる物質の量によって測定されます。溶解度は、物質と溶媒の性質と極性、さらには pH や塩分などの要因によって決まります。
| 外観 | 灰色/黒色の結晶または無色の結晶性固体を伴う白色の粉末3 |
| 比重 | 2.22 |
| 色 | 無色(純粋)または灰色/茶色(技術的品質) |
| 匂い | 無臭(純粋)またはニンニク様(工業グレード) |
| モル質量 | 64,099 g/モル |
| 密度 | 2.22g/cm3 |
| 融合点 | 2160℃ |
| 沸点 | 2300℃ |
| フラッシュドット | 305℃(アセチレン) |
| 水への溶解度 | 急速な加水分解 |
| 溶解性 | エタノール、エーテルに不溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 2.21 (アセチレン) |
| pKa | 適用できない |
| pH | 適用できない |
炭化カルシウムの安全性と危険性
CaC2 は可燃性で危険な化学物質です。水や湿気と接触すると、火災や爆発の危険を引き起こす可能性があります。アセチレンガスが発生しますが、これも引火性、爆発性があります。 CaC2 は健康を害する可能性もあります。皮膚、目、肺を刺激する可能性があります。発疹、目の損傷、咳、息切れを引き起こす可能性があります。また、大量に吸い込んだ場合、肺に液体が蓄積する可能性があります。 CaC2 との接触を避け、取り扱うときは保護具を着用する必要があります。また、発火源から離れた乾燥した密閉容器に保管してください。
| ハザードシンボル | F(引火性が高い)、C(腐食性)、W(水と反応する) |
| セキュリティの説明 | S2 (子供の手の届かないところに保管する)、S7/8 (容器をしっかりと閉めて乾燥した状態に保管する)、S16 (発火源から遠ざける)、S26 (目に入った場合は、すぐに多量の水で洗い流し、医師の診察を受けてください)アドバイス)、S36/37/39 (適切な保護服、手袋、目/顔の保護具を着用してください)、S43 (火災の場合は、乾燥砂または乾燥化学粉末を使用してください)、S45 (事故や不快感が発生した場合は、すぐに医師の診断を受けてください) |
| 国連識別番号 | 国連 1402 |
| HSコード | 28491000 |
| 危険等級 | 4.3 |
| 梱包グループ | 私 |
| 毒性 | 経口 LD50 ラット: 80 mg/kg、LC50 吸入ラット: 1000 ppm/4h |
炭化カルシウムの合成方法
カルシウムおよび炭素酸化物源から CaC2 を合成するにはさまざまな方法があります。
最も一般的な方法の 1 つは電気炉法です。このプロセスでは、電気アークが石灰とコークスの混合物を約 2,200°C まで加熱します。この反応は吸熱反応であり、溶融 CaC2 と一酸化炭素が生成されます。溶けた後、CaC2 は冷却され、用途に応じて細かく砕かれたり粉末になったりします。この方法はエネルギー消費と設備コストが高くなります。
もう一つの方法はソリッドステート法です。この方法を実行するには、酸化カルシウムとバイオ炭またはバイオマス由来の木炭の混合物をオーブンで約 1,750°C まで加熱します。反応は固体-固体であり、固体の CaC2 と一酸化炭素が生成されます。 CaC2 固体を直接使用することも、さらに加工することもできます。この方法は電気炉法に比べてエネルギー消費量が少なく、設備コストも低く抑えられます。
第三の方法は、石炭コークス発電品質代替法である。このプロセスを実行するには、低品位の石炭と石灰を混合し、ペレットを形成し、その後オーブンで 1000°C で熱分解します。発生したガスによって電気が発生し、熱いペレットが 2000°C の CaC2 オーブンに移されます。反応は固体-固体であり、溶融 CaC2 と一酸化炭素が生成されます。冷却後、溶融した CaC2 を粉砕して塊または粉末を形成します。この方法は電気炉法に比べてエネルギー効率が高く、資源利用率が高い。
炭化カルシウムの用途
- CaC2 が水と反応すると、アセチレンガスと水酸化カルシウムが生成されます。アセチレンガスは、ポリ塩化ビニル、酢酸ビニル、1,4-ブタンジオールなど、多くの有機化学物質やポリマーを合成するための重要な中間体です。水酸化カルシウムは、複数の用途を持つ多用途の化合物です。
- カルシウムシアナミドを生成するために、人間は高温で CaC2 を窒素と反応させます。カルシウムシアナミドは、窒素肥料、除草剤、枯葉剤として作用します。
- 鉄、鋳鉄、鋳鉄、鋼の硫黄含有量を減らすために、CaC2が使用されます。この化合物は硫黄と反応して硫化カルシウムを形成し、金属を効果的に脱硫します。このプロセスにより、鋼製品の品質と延性が向上します。
- カーバイドランプは、CaC2 を使用してアセチレンガスを生成し、燃焼すると光が発生します。これらのランプは、電球が一般的になる前に、鉱業、洞窟探検、自転車産業、自動車産業で人気がありました。
- 人々はバナナ、マンゴー、パパイヤなどの果物の熟成剤として CaC2 を使用しています。エチレンガスを放出し、果実の熟成を促進し、色と甘みを増します。多くの国では、果物を追熟するために CaC2 残留物を使用する行為は、それに伴う健康リスクのため違法かつ有害であると考えられています。
- 人々は大きな音を出すために竹大砲やビッグバン大砲に CaC2 を使用しています。水と混ぜるとアセチレンガスが発生し、それが点火してみんなで楽しくお祭り気分を味わえます。
- 製鉄の脱酸剤としても使用されます。溶鋼から酸素を除去し、鉄鋼製品の品質に影響を与える可能性のある酸化物の生成を防ぎます。
質問:
Q: 炭化カルシウムはどこで購入できますか?
A: お住まいの地域の金物店や溶接用品店で少量の CaC2 を見つけることができる場合があります。ただし、大量の CaC2 が必要な場合は、メーカーから直接輸入するのが最適な場合があります。一部のサプライヤーにはオンラインで問い合わせることができます。
Q: 炭化カルシウムを除去するにはどうすればよいですか?
A: CaC2 は有害廃棄物であるため、適切に処分する必要があります。水と反応して引火性、爆発性のアセチレンガスを発生する可能性があるため、ゴミ箱や排水溝に捨てないでください。 CaC2 を安全に処分する方法についてのアドバイスについては、地元の有害廃棄物当局または認可された廃棄物処理会社に問い合わせてください。換気の良い場所で水で中和し、輸送の際は密閉容器に梱包する必要がある場合があります。
Q: 炭化カルシウムが重水と反応すると何が生成しますか?
A: 重水は、水素の代わりに重水素を含む水です。重水素は、原子核内に 1 つの陽子と 1 つの中性子を持つ水素の同位体です。 CaC2 が重水と反応すると、水酸化カルシウムと重水素化アセチレンが生成されます。重水素化アセチレンは、水素の代わりに重水素を含むアセチレンです。この反応の化学式は次のとおりです。
CaC2 + 2D2O -> Ca(OD)2 + C2D2
Q: 炭化カルシウムは危険ですか?
A: はい、CaC2 は危険なので、慎重に取り扱う必要があります。水や湿気と接触すると、可燃性かつ爆発性のアセチレンガスを放出するため、火災や爆発の危険を引き起こす可能性があります。また、皮膚、目、肺を刺激する可能性があるため、健康を損なう可能性があります。 CaC2 は、皮膚の発疹、目の損傷、咳、息切れを引き起こす可能性があります。また、大量に吸い込んだ場合、肺に液体が蓄積する可能性があります。 CaC2 との接触を避け、取り扱うときは保護具を着用する必要があります。また、発火源から離れた乾燥した密閉容器に保管してください。
Q: 炭化カルシウムはイオン性ですか、それとも共有結合性ですか?
A: CaC2 はイオン性化合物です。カルシウムイオン(Ca2+)と炭化物イオン(C22-)で構成されています。イオン性化合物は、金属原子が電子を失い、非金属原子が電子を獲得して安定した電子配置を達成するときに形成されます。結果として生じるイオンは、静電気引力によって一緒に保持されます。 CaC2 は強いイオン結合を持っており、切断するには多くのエネルギーが必要です。
Q: 炭化カルシウムはどのように作られるのですか?
A: CaC2 は、石灰 (酸化カルシウム) とコークス (炭素) の混合物を電気炉で約 2200°C に加熱することによって得られます。この反応は吸熱反応であり、溶融 CaC2 と一酸化炭素が生成されます。次に、溶融した CaC2 を冷却し、小片または粉末に粉砕します。この方法はエネルギー消費と設備コストが高くなります。また、バイオ炭や低品位炭などの異なる炭素源を使用する方法や、固体加熱や誘導加熱などの異なる加熱方法を使用する方法もあります。これらの方法は、電気炉法よりもエネルギー消費量と設備コストを低く抑えることができます。
Q: 炭酸カルシウムを炭化カルシウムに変えることはできますか?
A: いいえ、炭酸カルシウムを直接 CaC2 に変換することはできません。炭酸カルシウムは、高温でも炭素と反応しない安定した化合物です。炭酸カルシウムは、まず空気の不在下で強く加熱して酸化カルシウムに変換する必要があります(焼成)。次に、酸化カルシウムを高温で炭素と反応させて CaC2 (浸炭) を生成します。このプロセスの全体的な化学方程式は次のとおりです。
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
Q: 次の反応のうち正しいものはどれですか? Ca(s) + 2C(s) -> CaC2(s) + 62.8 kJ
A: 次のステートメントは反応に当てはまります。
- 2 つ以上の元素が結合して化合物を形成する合成反応です。
- これは発熱反応であり、熱が環境中に放出されます。
- これは酸化還元反応であり、カルシウムが酸化され、炭素が還元されます。
- これは、酸化カルシウムと炭素から CaC2 が生成する逆反応です。
Q: cac2(s) の標準生成熱はどれくらいですか?
A: cac2(s) の標準生成熱は、25°C、1 atm で標準状態の元素から 1 モルの CaC2 が生成されるときのエンタルピー変化です。これは、ヘスの法則を使用して、指定された熱化学方程式から計算できます。 CaC2 形成の全体的な方程式は次のとおりです。
Ca(s) + 2C(s) -> CaC2(s)
ヘスの法則を使用すると、次のように書くことができます。
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414.79 kJ + 65.19 kJ + 462.30 kJ – 221.00 kJ – 571.80 kJ = -680.10 kJ
したがって、cac2(s) の標準生成熱は -680.10 kJ/mol です。
Q: 0.35 モルの hcch(g) を生成するには何グラムの cac2 が必要ですか?
A: この質問に答えるには、CaC2 と水の反応に平衡式を使用する必要があります。
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
この式から、1 モルの cac2 から 1 モルの hcch (アセチレンとも呼ばれる) が生成されることがわかります。したがって、0.35 モルの hcch を生成するには、0.35 モルの cac2 が必要です。モルからグラムに変換するには、cac2 のモル質量 (64.099 g/mol) を使用する必要があります。モルにモル質量を掛けると、次のようになります。
0.35 モル x 64.099 g/モル = 22.435 g
したがって、0.35 モルの hcch を生成するには、22.435 グラムの cac2 が必要です。
Q: 49.0 gの水と完全に反応するには何モルのcac2が必要ですか?
A: この質問に答えるには、炭化カルシウムと水の反応に平衡式を使用する必要があります。
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
この式から、1 モルの cac2 が 2 モルの h2o と反応することがわかります。したがって、必要な cac2 のモルを求めるには、h2o のモルを 2 で割る必要があります。グラムからモルに変換するには、水のモル質量、18.015 g/mol を使用する必要があります。グラムをモル質量で割ると、次のようになります。
49.0 g / 18.015 g/mol = 2.72 モル
これを 2 で割ると次のようになります。
2.72 モル / 2 = 1.36 モル
したがって、49.0 g の h2o と完全に反応するには、1.36 モルの cac2 が必要です。
Q: 炭化カルシウムと水の反応生成物は何ですか?
A: CaC2 と水の反応生成物は、アセチレンガスと水酸化カルシウム溶液です。
