水酸化銅 (Cu(OH)2) は、銅塩と水酸化物イオンの反応によって形成される青色の固体です。殺菌剤として、またさまざまな化学プロセスで使用されます。
| IUPAC名 | 水酸化銅(II) |
| 分子式 | Cu(OH)2 |
| CAS番号 | 20427-59-2 |
| 同義語 | 水酸化銅;二水酸化銅; CuOH2 |
| インチチ | InChI=1S/Cu・2H2O/h;2*1H2/q+2;;/p-2 |
水酸化銅の性質
水酸化銅の配合
水酸化第二銅の化学式はCu(OH)2です。これは、銅イオン (Cu2+) とイオン結合によって結合された 2 つの OH イオンの組み合わせを表します。この青色の固体化合物は、その独特の特性によりさまざまな産業で一般的に使用されています。
水酸化銅のモル質量
水酸化第二銅 (Cu(OH)2) のモル質量は、その構成元素の原子質量を加算することで計算できます。銅 (Cu) の原子質量は約 63.55 g/mol、各 OH- イオンの合計原子質量は約 17.01 g/mol です。したがって、水酸化第二銅のモル質量は約 97.55 g/mol です。
水酸化銅の沸点
水酸化銅は沸点に達する前に分解するため、明確な沸点がありません。加熱すると熱分解反応が起こり、酸化銅と水蒸気が生成します。
水酸化銅の融点
水酸化銅の融点は約 200°C (392°F) です。この温度では、固体は相転移を起こし、液体状態に変わります。
水酸化銅の密度 g/mL
水酸化第二銅の密度は約 3.36 g/mL です。この値は 1 ミリリットルの水酸化第二銅の質量を表し、その緻密さと濃度を示します。
水酸化銅の分子量
水酸化第二銅の分子量は約 97.55 g/mol です。これは、水酸化第二銅の分子に存在するすべての原子の原子量を加算することによって計算されます。
水酸化銅の構造
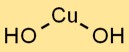
水酸化第二銅は、Cu2+ イオンが OH- イオンに囲まれた三方晶系の平面配置を有する結晶構造をとります。この結晶格子の配置は、その安定性と独特の特性に貢献しています。
水酸化銅の溶解度
水酸化第二銅は水への溶解度が限られています。それは水に難溶性の懸濁液を形成します。これは、少量の化合物しか溶媒に溶解しないことを意味します。溶解度は、温度や pH などの要因によって影響を受ける可能性があります。
| 外観 | ソリッドブルー |
| 比重 | ~3.36g/mL |
| 色 | 青 |
| 匂い | 無臭 |
| モル質量 | ~97.55 g/モル |
| 密度 | ~3.36g/mL |
| 融合点 | ~200°C (392°F) |
| 沸点 | 分解された |
| フラッシュドット | 該当なし |
| 水への溶解度 | 難溶性 |
| 溶解性 | 制限あり、温度と pH レベルによって変化します |
| 蒸気圧 | 該当なし |
| 蒸気密度 | 該当なし |
| pKa | 該当なし |
| pH | アルカリ性(塩基性) |
水酸化銅の安全性と危険性
水酸化銅には、安全性と危険性について一定の考慮事項があります。一般に毒性は低いと考えられていますが、接触または吸入すると皮膚、目、気道に炎症を引き起こす可能性があります。この化合物を取り扱うときは、手袋や安全メガネを着用するなど、適切な保護措置を講じる必要があります。摂取または誤って暴露した場合は、直ちに医師の診察が必要です。さらに、水酸化銅は、不適合物質から離れた安全で換気の良い場所に保管する必要があります。環境の汚染を避けるために、適切な廃棄手順に従う必要があります。水酸化銅に関連する潜在的なリスクを最小限に抑えるには、安全上の注意事項に従うことが重要です。
| ハザードシンボル | なし |
| セキュリティの説明 | 毒性が低い。刺激物 |
| 国連識別番号 | 適用できない |
| HSコード | 2825.90.5000 |
| 危険等級 | 危険物として分類されていない |
| 梱包グループ | 未分類 |
| 毒性 | 弱い |
水酸化銅の合成法
水酸化第二銅を合成するにはいくつかの有効な方法があります。
一般的なアプローチには、 CuSO4などの Cu 塩と、水酸化ナトリウム (NaOH) や水酸化カリウム (KOH)などの強塩基との反応が含まれます。このプロセス中に、塩基からの水酸化物イオン (OH-) がCuSO4中の硫酸イオン (SO4^2-) を置き換え、水酸化第二銅 (Cu(OH)2) を青色の沈殿物として形成します。
別の方法には、銅(II)塩とアンモニア (NH3) の反応が含まれます。アンモニアを Cu(II) 溶液に添加すると、Cu2+ イオンとアンモニアの水酸化物イオンの結合により水酸化第二銅が沈殿します。
電気分解では、Cu電極を電解液に浸し、直流電流を流すことで水酸化第二銅を合成します。カソードでの水の還元により水酸化物イオンが生成され、水酸化第二銅の形成につながります。
これらの活性合成法は、さまざまな産業および研究用途に水酸化第二銅を生産するための制御された効率的な手段を提供します。
水酸化銅の用途
水酸化銅は、そのユニークな特性と多用途な性質により、さまざまな産業で複数の用途が見出されます。注目すべき用途には次のようなものがあります。
- 殺菌剤:農家は、果物、野菜、観賞植物などの作物の真菌性疾患を制御するための保護殺菌剤として広く使用しています。
- 化学中間体: 酸化銅や銅塩など、さまざまな銅化合物の合成における貴重な化学中間体として機能します。
- 木材防腐剤:木材を処理し、木材を食べる昆虫や腐敗の原因となる菌類から保護し、木造構造物の寿命を延ばします。
- 抗菌剤: 一部の製剤では抗菌剤として作用し、医療およびヘルスケアの現場で応用されています。
- 水生処理:池、湖、その他の水域の藻類や水生雑草を管理し、生態学的バランスを維持するのに役立ちます。
- セラミックおよびガラス産業: メーカーは、セラミックおよびガラス製品に鮮やかな青と緑の色合いを与える着色剤として使用します。
- 花火:花火や発煙筒の発色に貢献し、花火用途で活躍します。
- 電池の製造: 電池の製造に電極材料として使用され、エネルギー貯蔵を促進します。
- 塗料とコーティング: 一部の塗料配合物には、保護特性と抗菌特性を与えるためにそれが組み込まれています。
用途の多様性は、複数の産業における水酸化銅の重要性を際立たせており、水酸化銅をさまざまな実用用途にとって価値のある化合物としています。
質問:
Q: 水酸化銅は溶けますか?
A: 水酸化銅は水への溶解度が限られており、難溶性の懸濁液を形成します。
Q: 68 グラムの水酸化銅(II) Cu(OH)2 は何モルですか?
A: 68 グラム中に約 0.697 モルの Cu(OH)2 が含まれています。
Q: 水酸化銅 II は水に溶けますか?
A: 水酸化第二銅は水への溶解度が限られています。
Q: 水酸化ナトリウムと硫酸銅は化学反応ですか?
A: はい、NaOH と CuSO4 の反応により、水酸化第二銅と硫酸ナトリウムが生成されます。
Q: 水酸化銅(II)は溶けますか?
A: 水酸化銅(II)の水への溶解度は限られています。
Q: 水酸化銅の色は何色ですか?
A: 水酸化第二銅は青色です。
Q: 水酸化銅はアルカリですか?
A: 水酸化銅は塩基ですが、アルカリには分類されません。
Q: 水酸化銅は強塩基ですか?
A: 水酸化銅は強塩基とはみなされません。
Q: Cu(OH)2 は水に溶けますか?
A: Cu(OH)2 の水への溶解度は限られています。
Q: 68 グラムの水酸化銅(II) Cu(OH)2 は何モルですか?
A: 68 グラム中に約 0.697 モルの Cu(OH)2 が含まれています。
Q: 34 グラムの Cu(OH)2 は何モルですか?
A: 34 グラム中に約 0.3485 モルの Cu(OH)2 が含まれています。
Q: 0.075 gのKOHを1.0 LのCu(NO3)2に1.0 × 10^−3 Mで溶解すると、固体のCu(OH)2が形成されますか?
A: はい、KOH と Cu(NO3)2 の反応により、固体の Cu(OH)2 が沈殿として形成されます。
