水酸化バリウムは、式 Ba(OH)2 の化合物です。これは水によく溶ける白色の結晶固体であり、研究室や工業プロセスで一般的に使用されます。
| IUPAC名 | 二水酸化バリウム |
| 分子式 | Ba(OH)2 |
| CAS番号 | 17194-00-2 |
| 同義語 | 水酸化バリウム(II)、重晶石、水和バリウム、二水和バリウム、ビス(水酸化バリウム)、ビス(オキシダニル)バリウム水和物 |
| インチチ | InChI=1S/Ba・2H2O/h;2*1H2/q+2;;/p-2 |
水酸化バリウムのモル質量
水酸化バリウムのモル質量は 171.34 g/mol です。これは 1 つのバリウム イオン (Ba2+) と 2 つの水酸化物イオン (OH-) で構成され、それぞれのモル質量はそれぞれ 137.33 g/mol と 17.01 g/mol です。水酸化バリウムのモル質量は、反応に必要な化合物の量を決定したり、溶液の濃度を計算したりするために重要です。
水酸化バリウムの配合
水酸化バリウムの化学式はBa(OH)2です。 1 つのバリウム イオン (Ba2+) と 2 つの水酸化物イオン (OH-) で構成されます。水酸化バリウムの式は、反応に必要な化合物の量を決定したり、溶液の濃度を計算したりするために重要です。化合物の構造と溶液中での挙動を表すためにも使用されます。
Ba(OH)2の沸点
Ba(OH)2 は沸騰する前に分解するため、沸点は明確に定義されていません。 Ba(OH)2 は強塩基であり、空気中の二酸化炭素と容易に反応して、炭酸バリウムと水が形成されます。 Ba(OH)2 の分解温度は溶液の濃度によって異なりますが、通常は 780°C 以上です。
Ba(OH)2 融点
Ba(OH)2 の融点は 407°C です。それは白色の無臭の結晶の形で固体状態で存在します。加熱すると、Ba(OH)2 は可逆反応を起こして酸化バリウムと水を形成します。 Ba(OH)2 の融点は、安全に取り扱い、保管できる温度を決定する上で重要です。
Ba(OH)2 密度 g/ml
固体 Ba(OH)2 の密度は 3.22 g/cm3 です。溶液中では濃度に応じて密度が変化します。たとえば、Ba(OH)2 の 10% 溶液の密度は 1.17 g/cm3 です。 Ba(OH)2 の密度は、反応に必要な溶液の体積を決定するとき、または化合物を取り扱うときに重要です。
Ba(OH)2 分子量
Ba(OH)2 の分子量は 171.34 g/mol です。これは、1 つのバリウム イオンと 2 つの水酸化物イオンの原子量の合計です。 Ba(OH)2 の分子量は、反応に必要な化合物の量を決定したり、溶液の濃度を計算したりするために重要です。
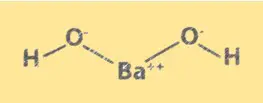
構造式 Ba(OH)2
Ba(OH)2 は塩化ナトリウムに似た結晶構造を持っています。 Ba2+ イオンと OH- イオンが立方格子状に配置されたものです。 Ba2+ イオンは立方体の角を占め、OH- イオンは各面の中心を占めます。 Ba(OH)2 の構造は、その化学的特性と溶液中での挙動を理解するために重要です。
| 外観 | 白色の結晶固体 |
| 比重 | 3.22g/cm3(固形分) |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 171.34 g/モル |
| 密度 | 2.18 g/cm3 (水溶液、10% w/w、25℃) |
| 融合点 | 407℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水に非常に溶けやすい |
| 溶解性 | アルコール、アセトンに可溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | アルカリ性 (pH > 7) |
注: この表に示されている値は一般的な説明であり、特定の条件や物質の濃度によって異なる場合があります。
水酸化バリウムの安全性と危険性
Ba(OH)2 は、皮膚、目、気道に重度の刺激を引き起こす可能性のある非常に腐食性の高い有毒物質です。慎重に取り扱い、手袋や安全メガネなどの適切な個人用保護具を着用することが重要です。吸入または飲み込んだ場合、肺、消化器系、腎臓に重大な損傷を引き起こす可能性があります。酸や酸化剤などの不適合物質から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。流出または暴露の場合は、その場から避難し、ただちに医師の診察を受けるなど、適切な緊急手順に従ってください。
| ハザードシンボル | 腐食性 |
| セキュリティの説明 | 皮膚や目との接触を避けてください。保護服と手袋を着用してください。換気の良い場所でのみ使用してください |
| AN識別子 | 国連 1564 |
| HSコード | 2816.40.00 |
| 危険等級 | 8 |
| 梱包グループ | Ⅱ |
| 毒性 | 経口摂取、吸入、皮膚吸収により有毒。深刻な皮膚や目に炎症を引き起こします。気道の炎症や腎臓の損傷を引き起こす可能性がある |
水酸化バリウムの合成方法
Ba(OH)2 は、酸化バリウム (BaO) と水 (H2O) の反応、塩化バリウム (BaCl2) と水酸化ナトリウム (NaOH) の反応など、いくつかの方法で合成できます。
最初の方法では、所望の濃度に達するまで、絶えず撹拌しながら酸化バリウムを蒸留水にゆっくりと加えます。次いで、得られた溶液を濾過し、乾燥させて、固体形態のBa(OH) 2 を得る。
第 2 の方法では、所望の pH に達するまで、絶えず撹拌しながら塩化バリウム溶液を水酸化ナトリウム溶液にゆっくりと加えます。次いで、得られた溶液を濾過し、乾燥させて、固体形態のBa(OH) 2 を得る。
別の方法には、硫化バリウム (BaS) と水の反応が含まれ、Ba(OH)2 と硫化水素ガス (H2S) が生成されます。
Ba(OH)2 は、溶融バリウム塩の電気分解または高温での炭酸バリウム (BaCO3) の熱分解によっても調製できます。
全体として、Ba(OH)2 の合成には、その高度な腐食性と毒性のため、慎重な取り扱いと適切な安全上の予防措置が必要です。危険物を扱う場合は、適切な安全プロトコルと規制に従うことが重要です。
水酸化バリウムの用途
Ba(OH)2 は、その高い反応性とアルカリ性の性質により、いくつかの産業および実験室で使用されています。その主な用途の 1 つは、潤滑剤、プラスチック、殺虫剤などのさまざまな化学物質の製造における化学試薬としてです。
Ba(OH)2 は、熱や紫外線による変色や劣化を防ぐために、PVC やその他のプラスチックの安定剤としても使用されます。光学ガラスや高屈折率ガラスなど、特定の種類のガラスの製造にも使用されます。
研究室では、Ba(OH)2 はエステル化やエステル交換反応などのさまざまな有機反応の触媒として使用されます。また、分析化学における弱酸の測定や標準溶液の調製における滴定剤としても使用されます。
Ba(OH)2 のもう 1 つの用途は、テレビやコンピュータ モニター用の陰極線管の製造に使用される酸化バリウムの製造です。
Ba(OH)2 は、環境に排出する前に不純物を除去し、酸性またはアルカリ性の廃水を中和するために工業廃水の処理にも使用されます。
全体として、Ba(OH)2 は多くの産業や研究室で重要な役割を果たし、多くの製品やプロセスの生産に貢献しています。
質問:
水酸化バリウムは溶けますか?
はい、水酸化バリウムは水溶性です。水に溶解すると、pH約12.5のアルカリ性溶液になります。 Ba(OH)2 の水への溶解度は比較的高く、室温 (25 °C) での溶解度は約 3.52 g/100 mL です。 Ba(OH)2 の溶解度は、温度、圧力、溶液中の他の物質の存在などの要因によって影響を受ける可能性があります。
水酸化バリウムは強塩基ですか?
はい、水酸化バリウムは強塩基です。水に溶解すると完全に解離して、溶液中にバリウムイオン(Ba2+)と水酸化物イオン(OH-)が形成されます。この解離により、pH 約 12.5 の高アルカリ性溶液が生成されます。 Ba(OH)2 の強塩基性により、酸性流出物の効果的な中和剤およびさまざまな有機反応における触媒になります。
水酸化バリウムの化学式は何ですか?
水酸化バリウムの式はBa(OH)2です。この式は、水酸化バリウムの各分子に 1 つのバリウム イオン (Ba2+) と 2 つの水酸化物イオン (OH-) が含まれていることを示します。バリウム イオンは +2 の電荷を持ち、水酸化物イオンは -1 の電荷を持ちます。 Ba(OH)2 内の 2 つの水酸化物イオンは、バリウム イオンの +2 電荷のバランスをとり、中性の化合物を生成します。 Ba(OH)2 の式は、その特性と反応を理解するだけでなく、モル質量やその他の物理化学的特性を計算するためにも重要です。
