水酸化カルシウム (Ca(OH)2) は、食品生産、水処理、建設などのさまざまな用途に使用される化合物です。酸化カルシウムを水と混ぜて作られており、白い粉末状の外観をしています。
| IUPACの名称 | 水酸化カルシウム |
| 分子式 | Ca(OH)2 |
| CAS番号 | 1305-62-0 |
| 同義語 | 消石灰、消石灰、ライムミルク、ピクルスライム |
| インチチ | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
水酸化カルシウムの性質
水酸化カルシウムの配合
水酸化カルシウムの化学式は Ca(OH)2 です。これは、水酸化カルシウムの各分子に 1 つの Ca2+ イオンと 2 つの OH- イオンが含まれていることを意味します。式は化合物内の原子の数と種類を表すため、化学において重要です。
水酸化カルシウムのモル質量
Ca(OH)2 のモル質量は 74.09 g/mol です。 1 つのカルシウム原子、2 つの酸素原子、2 つの水素原子で構成されています。モル質量は、特定のサンプル中の物質の量を計算するために使用されるため、化学において重要な特性です。
水酸化カルシウムの沸点
Ca(OH)2 は 2400°C という非常に高い沸点を持っています。つまり、液体から気体に変化するにはかなりの熱が必要になります。沸点が高いのは、カルシウムイオンと水酸化物イオンの間の強いイオン結合によるものです。
水酸化カルシウムの融点
Ca(OH)2 の融点は 580°C と比較的低いです。これは、簡単に溶かしてさまざまな形状に成形できることを意味します。融点が低いのは、化合物のイオン性によるもので、加熱するとイオンがより自由に移動できるようになります。
水酸化カルシウムの密度 g/mL
Ca(OH)2 の密度は 2.24 g/mL です。これは、密度が 1 g/mL である水と比較して、比較的重い化合物であることを意味します。高密度は、Ca2+ イオンと OH- イオンの非常に緻密な性質によるものです。
水酸化カルシウムの分子量
Ca(OH)2 の分子量は 74.09 g/mol です。これは、化合物内のカルシウム、酸素、および水素原子の原子量の合計です。分子量は、モル濃度や組成百分率などのさまざまなパラメータの計算に使用されるため、化学において重要な特性です。
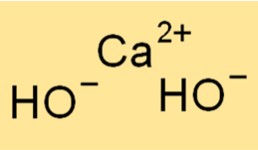
水酸化カルシウムの構造
Ca(OH)2 は、各カルシウム イオンが 6 つの水酸化物イオンによって八面体配置で囲まれた結晶構造を持っています。この構造により、化合物に特徴的な白く粉状の外観が与えられます。 Ca2+ イオンと OH- イオン間のイオン結合は強いため、化合物に高い融点と沸点が与えられます。
| 外観 | 白い粉 |
| 比重 | 2.24 g/cm3 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 74.09 g/モル |
| 密度 | 2.24 g/cm3 |
| 融合点 | 580℃ |
| 沸点 | 2,400℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 1.7g/L(20℃) |
| 溶解性 | 酸に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 12.5 (最初の解離) |
| pH | 12.5 (0.1M溶液、25℃) |
水酸化カルシウムの安全性と危険性
Ca(OH)2 は一般に、正しく取り扱われれば安全であると考えられています。ただし、摂取、吸入、または皮膚や目に接触した場合は有害となる可能性があります。炎症、火傷、呼吸障害を引き起こす可能性があります。化合物からの粉塵も呼吸器系を刺激する可能性があります。 Ca(OH)2 を取り扱うときは、手袋、ゴーグル、マスクなどの保護具を着用する必要があります。また、化合物は、不適合物質から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。接触または摂取した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | シー(イライラする) |
| セキュリティの説明 | 保護手袋と目/顔の保護具を着用してください。 |
| 国連識別番号 | 1910年 |
| HSコード | 2825.90.90 |
| 危険等級 | 8 – 腐食性物質 |
| 梱包グループ | Ⅲ |
| 毒性 | 一般に、水酸化カルシウムは、正しく取り扱われれば無毒であると考えられています。ただし、摂取または吸入すると、呼吸器系や消化管を刺激して火傷を負う可能性があります。 |
水酸化カルシウムの合成方法
Ca(OH)2 はさまざまな方法で合成できます。
Ca(OH)2 を合成する一般的な方法は、水を酸化カルシウムと反応させ、消石灰または消石灰を形成することです。
別の方法には、塩化カルシウムと水酸化ナトリウムの反応が含まれます。水と二酸化炭素と炭酸カルシウムが反応すると、Ca(OH)2 が生成されます。
水和プロセスでは、消石灰法を使用して水と酸化カルシウムを混合します。この反応では、副生成物として Ca(OH)2 と熱が生成されます。このプロセスでは、得られたペーストから不純物と余分な水分がさらに除去されます。
塩化カルシウム法では、塩化カルシウムと水酸化ナトリウムを複分解と呼ばれるプロセスで混合します。
この反応では、副生成物として Ca(OH)2 と塩化ナトリウムが生成されます。次いで、得られたCa(OH) 2 を精製し、乾燥させる。
炭酸カルシウム法では、まず炭酸カルシウムを加熱して酸化カルシウムと二酸化炭素を生成します。水和プロセスには、酸化カルシウムと水の混合が含まれ、Ca(OH)2 が生成されます。
水酸化カルシウムの用途
Ca(OH)2 は、次のようなさまざまな産業で多くの用途があります。
- 建設: これらの材料を強化し、耐久性を高める能力があるため、コンクリート、モルタル、スタッコの製造における重要なコンポーネントとして使用されます。
- 農業: 土壌の酸性度を下げ、土壌肥沃度を向上させる土壌改良剤として使用されます。
- 水処理:マグネシウムイオンやカルシウムイオンなどの不純物を除去して水を軟化させるために使用されます。
- 化学品の製造: ステアリン酸カルシウム、次亜塩素酸カルシウム、リン酸カルシウムなどのさまざまな化学品の製造に使用されます。
- 食品産業: ピクルス、オリーブ、ソフトドリンクなどの食品の酸性度を調整するための食品添加物として使用されます。
- 医療産業: 抗菌および抗真菌特性により、根管治療や空洞充填などのさまざまな歯科処置に使用されます。
- 紙パルプ産業: 紙の光沢と強度を向上させるために紙の製造に使用されます。
- 皮革産業: 毛や不純物を除去するための皮革加工に使用されます。
質問:
Q: 水酸化カルシウムは溶けますか?
A: Ca(OH)2 は水に中程度に溶け、室温での溶解度は約 1.2 g/L です。
Q: 水酸化カルシウムの式は何ですか?
A: 水酸化カルシウムの式は Ca(OH)2 です。
Q: 近くの水酸化カルシウムはどこで買えますか?
A: Ca(OH)2 は化学薬品店、金物店、またはオンライン小売店で購入できます。お住まいの地域の近くの化学薬品店や金物店を検索したり、Amazon や eBay などのオンライン小売店をチェックしたりできます。
Q: Ca(OH)2 は酸ですか、それとも塩基ですか?
A: Ca(OH)2 は塩基です。これは水中で完全に解離してカルシウムイオン (Ca2+) と水酸化物イオン (OH-) を形成する強塩基です。
Q: H3PO4(aq)+Ca(OH)2(aq)→という反応が起こったとき、形成される塩の式は何ですか?
A: H3PO4(aq) と Ca(OH)2(aq) の反応では、リン酸カルシウム (Ca3(PO4)2) と水 (H2O) がそれぞれ塩と副生成物として生成されます。
Q: Ca(OH)2 は水に溶けますか?
A: はい、Ca(OH)2 は水に適度に溶けます。水に溶解して、室温で約 1.2 g/L の濃度の飽和溶液を形成します。
Q: Ca(OH)2 は強塩基ですか?
A: はい、Ca(OH)2 は強塩基です。これは、水中で完全に解離して Ca2+ および OH- イオンを形成し、強塩基となる高塩基性化合物です。
Q: HCl が Ca(OH)2 と反応するとどれが生成されますか?
A: HCl が Ca(OH)2 と反応すると、生成物は塩化カルシウム (CaCl2) と水 (H2O) になります。これは、HCl の H+ イオンが Ca(OH)2 の OH- イオンと反応して水が形成されるためです。残りの Ca2+ イオンと Cl- イオンは塩、塩化カルシウムを形成します。
