塩素酸カリウム (KClO3) は、カリウム、塩素、酸素から構成される化合物です。酸化特性があるため、マッチ、爆薬、花火の製造によく使用されます。
| IUPAC名 | 塩化カリウム |
| 分子式 | KClO3 |
| CAS番号 | 3811-04-9 |
| 同義語 | 塩素酸カリウム、クロルカリウム、塩素酸カリウム、過塩素酸カリウム、UN 1485、塩素酸カリウム、過塩素酸カリウム |
| インチチ | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
塩素酸カリウムの性質
塩素酸カリウムの配合
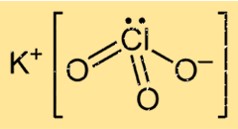
塩素酸カリウムの化学式は KClO3 で、カリウム原子 1 つ、塩素原子 1 つ、酸素原子 3 つで構成されていることを示します。 K+ イオンと ClO3- イオンがイオン結合を介して結合するときに形成されるイオン性化合物です。この化合物は酸素の存在により非常に反応性が高く、強力な酸化特性を与えます。
塩素酸カリウムのモル質量
KClO3 のモル質量は 122.55 g/mol です。これは、化合物を構成する個々の元素、つまりカリウム、塩素、酸素の原子質量の合計です。モル質量は、化学反応で一定量の生成物を生成するために必要な物質の質量を計算するために使用されるため、化学における重要なパラメーターです。
塩素酸カリウムの沸点
KClO3 は沸点に達する前に分解するため、明確に定義された沸点がありません。加熱すると塩化カリウムと酸素ガスに分解します。したがって、KClO3 は沸点ではなく熱分解反応を起こします。
塩素酸カリウム 融点
KClO3 の融点は 356°C (673°F) です。この温度では、固体化合物が溶けて液体に変わります。融点は、溶解度や密度などの物質の物理的挙動に影響を与えるため、化合物の重要な特性です。
塩素酸カリウムの密度 g/mL
KClO3 の密度は室温で 2.32 g/mL です。これは、化合物の特定の体積には特定の質量があることを意味し、特定の化学反応に必要な物質の質量を決定するのに役立ちます。 KClO3 の密度は水への溶解度にも影響します。密度が高い化合物ほど水に溶けにくい傾向があります。
塩素酸カリウムの分子量
KClO3 の分子量は 122.55 g/mol です。これは、その構成原子、つまりカリウム、塩素、酸素の原子量の合計です。分子量は、化学反応における反応物質と生成物の量を計算するために使用されるため、化学量論では必須のパラメーターです。
塩素酸カリウムの構造
KClO3 は固体の結晶構造を持ち、カリウム、塩素、酸素の原子が特定のパターンで配列されています。この化合物は面心立方結晶格子構造を形成しており、各カリウムイオンは 6 個の酸素原子に囲まれ、各酸素イオンは 4 個のカリウム原子と 2 個の塩素原子に囲まれています。
塩素酸カリウムの溶解度
KClO3 は水に中程度に溶解し、室温での溶解度は 7 g/水 100 ml です。水分子の運動エネルギーが大きくなり、より多くの化合物を溶解できるため、化合物の溶解度は温度とともに増加します。 KClO3 は、エタノールやアセトンなどの他の極性溶媒にも可溶です。
| 外観 | 白色の結晶固体 |
| 比重 | 2.32 g/cm3 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 122.55g/モル |
| 密度 | 2.32 g/cm3 |
| 融合点 | 356°C (673°F) |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 7 g/100 mL(20℃) |
| 溶解性 | エタノール、アセトンに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 1.8 (Ka = 1.6 × 10⁻⁵) |
| pH | 0.1 M 溶液の pH は約 6.5 ~ 7.5 です。 |
塩素酸カリウムの安全性と危険性
KClO3 は反応性が高く、潜在的に危険な物質であるため、取り扱いには細心の注意が必要です。深刻な皮膚や目に炎症を引き起こす可能性があり、飲み込んだり吸入すると有毒になる可能性があります。加熱すると激しく反応し、爆発することもあります。 KClO3 は、硫酸や有機化合物などの他の化学物質と強く反応し、塩素や二酸化塩素酸塩などの有毒ガスを生成する可能性があります。 KClO3 を扱う場合は、保護具の着用や換気の良い場所での作業など、適切な安全手順に従うことが重要です。
| ハザードシンボル | オ、シー、ン |
| セキュリティの説明 | 可燃物との接触を避けてください。飲み込むと有毒。重度の皮膚火傷や目の損傷を引き起こします。 |
| 国連識別番号 | UN1485 |
| HSコード | 2829.90.10 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 非常に有毒です |
塩素酸カリウムの合成法
KClO3 を合成するにはいくつかの方法があります。
1 つの方法には、塩化カリウムと漂白剤の反応が含まれます。この方法では、塩化カリウム溶液に漂白剤溶液を加え、混合物を撹拌します。 KClO3 を得るには、得られた沈殿を濾過して洗浄します。
別の方法には、塩化カリウム、水、および酸素源を含む溶液の電気分解が含まれます。特殊な装置である電解槽は、カリウムイオンと塩化物イオンを分離し、酸素ガスを生成することによってこのプロセスを実行します。酸素はカリウムイオンと反応して KClO3 を形成します。
3 番目の方法は、水酸化カリウムと塩素ガスの反応を伴い、塩化カリウムと水から KClO3 が生成されます。この方法では、最適な収率を確保するために、試薬の温度と濃度を注意深く制御する必要があります。
塩素酸カリウムの用途
KClO3 は、次のようなさまざまな業界で幅広い用途に使用されます。
- 火工品: 花火やその他の火工品の酸化剤として一般的に使用されます。
- マッチ: 粗い表面に当たると発火する安全マッチの頭に使用されます。
- 肥料:植物肥料のカリウム源として使用されます。
- 漂白剤: 繊維、紙、その他の素材の漂白剤として使用されます。
- 実験用試薬: さまざまな化学反応の実験用試薬としても使用されます。
- 医療用途: 湿疹などの特定の種類の皮膚疾患を治療するために医学的に使用されます。
- 爆発物: 雷管やダイナマイトなど、一部の種類の爆発物の一般的な成分。
- 酸化剤: 過塩素酸塩などの特定の化学物質の製造において酸化剤として使用されます。
質問:
Q: 25gの塩素酸カリウムが分解すると何gの塩化カリウムが生成されますか?
A: 25 g の KClO3 が分解すると、13.47 g の塩化カリウムが生成されます。
Q:塩素酸カリウムはどうやって作るのですか?
A: KClO3 は、塩化カリウムと漂白剤を反応させるか、塩化カリウムを含む溶液を電気分解するか、水酸化カリウムと塩素ガスを反応させることによって作ることができます。
Q: 2モルの塩素酸カリウム(kclo3)が分解すると、何モルの酸素が発生しますか?
A: 2 モルの KClO3 が分解すると、3 モルの酸素ガスが生成されます。
Q: 0.70 m の溶液には 3.0 g の塩素酸カリウム (kclo3) が含まれています。溶液の体積はどれくらいですか?
A: 3.0 g の KClO3 を含む 0.70 m 溶液の体積は 51.4 mL です。
Q: 塩素酸カリウムは揮発性ですか?
A: KClO3 は融点と沸点が比較的高いため、揮発性物質とは見なされません。
Q:2.50gのkclo3を分解するとどのくらいのkclが生成されますか?
A: 2.50 g の KClO3 が分解すると、1.35 g の塩化カリウムが生成されます。
Q: kclo3 は水に溶けますか?
A: はい、KClO3 は水への溶解度が高く、室温での溶解度は 7 g/100 mL です。
Q: kclo3 100 g を分解すると何グラムの酸素が生成されますか?
A: KClO3 100 g が分解すると、45.02 g の酸素ガスが発生します。
