塩化チオニルは、さまざまな産業用途で使用される化合物です。アルコールおよびカルボン酸と反応して、それぞれ対応する塩化物および塩化スルフリルを生成します。
| IUPACの名称 | 塩化チオニル |
| 分子式 | SOCl₂ |
| CAS番号 | 7719-09-7 |
| 同義語 | 二塩化硫黄、オキシ塩化硫黄、二塩化チオニル |
| インチチ | InChI=1S/Cl2OS/c1-4(2)3 |
塩化チオニルの性質
塩化チオニルの式
二塩化チオニルの式は SOCl2 で、2 つの塩素原子に結合した 1 つの硫黄原子を表します。さまざまな産業で広く使用されている化合物です。
塩化チオニル モル質量
二塩化チオニルのモル質量は、1 モルあたり約 118.97 グラムです。モル質量は、その構成要素の原子質量を加算することによって決定されます。
塩化チオニルの沸点
二塩化チオニルの沸点は約 79.6 ℃です。これは、液体の二塩化チオニルが気体に変化する温度です。
塩化チオニルの融点
二塩化チオニルの融点は約-104.5℃です。これは、固体の二塩化チオニルが液体の状態に変化する温度です。
塩化チオニルの密度 g/mL
二塩化チオニルの密度は 1 ミリリットルあたり約 1.64 グラムです。密度は単位体積あたりの質量の尺度であり、物質の重要な特性です。
塩化チオニルの分子量
二塩化チオニルの分子量は、1 モルあたり約 118.97 グラムです。硫黄、塩素、酸素の原子量を加算して計算されます。
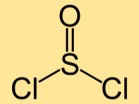
塩化チオニルの構造
二塩化チオニルの構造は、2 つの塩素原子に結合した硫黄原子から構成されます。硫黄原子と塩素原子が直線的に配置され、曲線状の分子を形成します。
塩化チオニルの溶解度
二塩化チオニルは水には溶けにくいですが、ベンゼン、トルエン、四塩化炭素などの有機溶媒にはよく溶けます。その溶解性はその用途において重要な要素です。
| 外観 | 無色~淡黄色の液体 |
| 比重 | 1,638g/mL |
| 色 | 無色 |
| 匂い | 辛くて息が詰まる |
| モル質量 | 118.97 g/モル |
| 密度 | 1,638g/mL |
| 融合点 | -104.5℃ |
| 沸点 | 79.6℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 激しく反応する |
| 溶解性 | ベンゼン、トルエン、四塩化炭素などの有機溶媒に可溶 |
| 蒸気圧 | 4.33 kPa(20℃) |
| 蒸気密度 | 3.9 (空気 = 1) |
| pKa | -6.3 |
| pH | 適用できない |
塩化チオニルの安全性と危険性
二塩化チオニルはいくつかの安全上のリスクを引き起こすため、慎重に取り扱う必要があります。非常に腐食性が高く、皮膚、目、粘膜に接触すると重度の火傷を引き起こす可能性があります。その蒸気を吸入すると、炎症や呼吸器損傷を引き起こす可能性があります。この化合物は水と激しく反応し、塩化水素などの有毒ガスを放出します。したがって、湿気の発生源から離して保管し、取り扱う必要があります。二塩化チオニルはアルコールや含水化合物とも激しく反応し、火災や爆発の危険を引き起こす可能性があります。二塩化チオニルの安全な取り扱いを確保するには、適切な換気、個人用保護具、および適切な保管方法が不可欠です。
| ハザードシンボル | 腐食性 (C)、有毒 (T)、環境に危険 (N) |
| セキュリティの説明 | – 湿気や混入しない物質の発生源から遠ざけてください。<br>- 換気の良い場所で使用し、適切な個人用保護具を着用してください。<br>- 皮膚、目、粘膜との接触を避けるため、慎重に取り扱ってください。<br> – 密閉した容器に入れて、涼しく乾燥した場所に保管してください。 |
| 国連識別番号 | 国連番号 1836 (二塩化チオニル) |
| HSコード | 2812.10.00 |
| 危険等級 | 8 (腐食性物質) |
| 梱包グループ | II(中程度に危険) |
| 毒性 | 吸入、経口摂取、皮膚吸収により非常に有毒です。<br>- 重度の火傷や呼吸器への刺激を引き起こす可能性があります。<br>- 水生生物に長期にわたる有害な影響を引き起こす可能性があります。 |
塩化チオニルの合成方法
さまざまな方法により、二塩化チオニルを合成できます。
一般的なアプローチには、活性炭や塩化アルミニウムなどの触媒の存在下での三酸化硫黄 (SO3) と二塩化硫黄 (SCl2) の反応が含まれます。反応は通常約 300 ~ 400 °C の高温で起こり、二塩化チオニルが生成します。
別の方法には、二酸化硫黄 (SO2) と五塩化リン (PCl5)またはオキシ塩化リン (POCl3) との直接反応が含まれます。この反応は試薬を徐々に添加しながら還流状態で起こり、二塩化チオニルが生成します。
硫黄と三塩化リン (PCl3)を反応させると二塩化チオニルが得られます。このプロセスには、反応物を加熱して二塩化チオニルを形成させることが含まれます。
別の方法には、塩化アルミニウムなどのルイス酸触媒の存在下での五硫化リン (P2S5) と五塩化リン (PCl5)との反応が含まれます。反応は高温で起こり、二塩化チオニルが生成します。
これらの合成方法では、含まれる試薬の危険な性質のため、適切な取り扱いと安全上の注意が必要であることに注意することが重要です。二塩化チオニルを安全かつ効率的に合成するには、経験豊富な化学者の専門知識と適切な実験器具の使用が必要です。
塩化チオニルの用途
二塩化チオニルは、その多用途な化学的特性により、さまざまな産業で幅広い用途が見出されます。二塩化チオニルの一般的な用途をいくつか示します。
- カルボン酸の変換: 二塩化チオニルは、主に有機合成におけるビルスマイヤー・ハック反応を使用して、カルボン酸を塩化アシルに変換します。
- アルコール塩素化: 二塩化チオニルはアルコールと反応して塩化アルキルを形成し、ダルゼンス反応として知られる医薬品や農薬用の塩素化化合物の製造に応用されます。
- 脱水剤: 二塩化チオニルは脱水剤として作用し、水からのさまざまな化合物の除去を促進します。これは、染料、香料、医薬中間体の合成に一般的に使用されます。
- リチウムイオン電池の製造: メーカーは二塩化チオニルを使用して、エネルギー密度が高く、保存寿命が長いリチウム二塩化チオニル電池を製造します。これらのバッテリーは、医療機器、軍事機器、遠隔センサーなどに応用されています。
- 重合反応: 二塩化チオニルは重合反応に関与し、ポリカーボネートやポリ無水物などのさまざまなポリマーの合成に寄与します。
- リン化合物: 二塩化チオニルは、三塩化リンなどのリン化合物と反応して、塩化ホスホリルを生成します。化学者はこれらの中間体を使用して有機リン酸塩化合物や難燃剤を合成します。
- 化学試薬: 二塩化チオニルは、エステル化、ハロゲン化、求核置換反応などの多くの化学変換において多用途試薬として機能します。
質問:
Q: 塩化チオニルは何で洗えますか?
A: 二塩化チオニルは、大過剰のアルコールまたはメタノールや重炭酸ナトリウム溶液などの適合性塩基ですすぐことができます。
Q: 吉草酸と塩化チオニルの生成物は何ですか?
A: 吉草酸と二塩化チオニルの反応では、塩化バレリルと二酸化硫黄ガスが生成されます。
Q: カルボン酸に塩化チオニルを加えることはできますか?
A: はい、二塩化チオニルをカルボン酸に加えると、ビルスマイヤー・ハック反応によって塩化アシルに変換できます。
Q: 塩化チオニル (SOCl2) の正しいルイス式は次のうちどれですか?
A: 二塩化チオニル (SOCl2) の正しいルイス式は、S=O | で表されます。 Cl – Cl。
Q: 何が塩化チオニル反応を引き起こすのですか?
A: 二塩化チオニルの反応は、さまざまな化学変換において求電子剤として作用する塩化チオニルの高い反応性によって引き起こされます。
Q: 塩化チオニルを消すにはどうすればよいですか?
A: 二塩化チオニルは、第一級または第二級アルコールなどの適切な失活剤を添加するか、水で注意深く加水分解することによって失活させることができます。
Q: アミンと塩化チオニルを混合すると何が得られますか?
A: アミンと二塩化チオニルを混合すると、対応するアミン塩酸塩が形成されます。
Q: 塩化チオニルとは何ですか?
A: 二塩化チオニルは化学式 SOCl2 で表される化合物で、有機合成の試薬や脱水剤として一般的に使用されます。
Q: 過剰な塩化チオニルはどのような影響を及ぼしますか?
A: 過剰な二塩化チオニルは激しい反応を引き起こし、有毒ガスの発生や爆発の危険を引き起こす可能性があるため、慎重に取り扱う必要があります。
Q: 塩化チオニルを中和するにはどうすればよいですか?
A: 二塩化チオニルは、適切な安全対策を講じながら、大過剰の適切な塩基 (重炭酸ナトリウムや水酸化ナトリウムなど) に慎重に添加することで中和できます。
