亜硝酸カリウム (KNO2) は、食品保存料として一般的に使用される化合物です。細菌の増殖を抑制し、肉やその他の食品の腐敗を防ぐことが知られています。
| IUPAC名 | 亜硝酸カリウム |
| 分子式 | KNO2 |
| CAS番号 | 7758-09-0 |
| 同義語 | 亜硝酸、カリウム塩;硝石(III);亜硝酸、化合物。カリウム塩(1:1)を加えたもの。 E249 |
| インチチ | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
亜硝酸カリウムの性質
亜硝酸カリウムの処方
亜硝酸カリウムの化学式は KNO2 です。化合物の構成を構成原子の観点から表します。亜硝酸カリウムの式は、そのモル質量と分子量を計算するために使用されます。
亜硝酸カリウム モル質量
KNO2 のモル質量は 85.103 g/mol です。これは、カリウム (39.10 g/mol)、窒素 (14.01 g/mol)、および 2 つの酸素原子 (2 x 16.00 g/mol) の原子質量の合計から求められます。 KNO2 のモル質量は、所定の質量または体積中に物質がどれだけ含まれるかを決定するのに不可欠です。
亜硝酸カリウムの沸点
KNO2 の沸点は 320°C (608°F) です。この温度では、化合物は液相から気相に変化します。 KNO2 の沸点は、圧力や純度などのさまざまな要因に依存します。
亜硝酸カリウムの融点
KNO2 の融点は 441°C (826°F) です。この温度では、固体化合物は液相に変化します。 KNO2 の融点は、食品保存や医薬品などのさまざまな用途への KNO2 の適合性を決定する重要なパラメーターです。
亜硝酸カリウムの密度 g/mL
KNO2 の密度は室温で 1.915 g/mL です。物質の密度は、単位体積あたりの物質の質量として定義されます。 KNO2 の密度は、溶解度や化学反応性などの物理的特性を決定する上で重要な役割を果たします。
亜硝酸カリウムの分子量
KNO2 の分子量は 85.103 g/mol です。これは、KNO2 が関与する反応の化学量論を決定するための重要なパラメーターです。 KNO2 の分子量は、その物理的および化学的特性を決定するためにも使用されます。
亜硝酸カリウムの構造
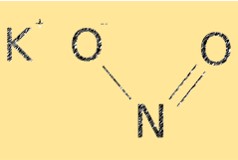
KNO2 の分子式は KNO2 です。カリウムカチオン (K+) と亜硝酸アニオン (NO2-) からなるイオン構造を持っています。亜硝酸イオンは湾曲した分子形状をしており、結合角は約 115°です。 KNO2 の構造は、溶解性や反応性などの化学的特性を決定するのに不可欠です。
亜硝酸カリウムの溶解度
KNO2 は水に非常に溶けやすく、20°C での溶解度は約 710 g/L です。 KNO2 の溶解度は、温度、圧力、他の物質の存在などのさまざまな要因に依存します。 KNO2 の溶解度は、食品保存や医薬品などのさまざまな用途への KNO2 の適合性を決定する重要なパラメーターです。
| 外観 | 白色から黄色がかった結晶性固体 |
| 比重 | 1,915 |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 85.103 g/モル |
| 密度 | 1.915g/mL |
| 融合点 | 441°C (826°F) |
| 沸点 | 320°C (608°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい(20℃で710 g/L) |
| 溶解性 | エタノールに溶ける、アンモニアにわずかに溶ける |
| 蒸気圧 | 0.0038 mmHg(25℃) |
| 蒸気密度 | 2.96 (空気 = 1) |
| pKa | 3.35 |
| pH | 5~8(5%溶液) |
亜硝酸カリウムの安全性と危険性
KNO2 は、取り扱いを誤ると危険です。飲み込んだり吸入すると有害であり、目、皮膚、呼吸器系に炎症を引き起こす可能性があります。 KNO2 への長期または繰り返しの曝露は、血液の酸素運搬能力を低下させる状態であるメトヘモグロビン血症を引き起こす可能性があります。 KNO2 は強力な酸化剤でもあり、可燃性物質と激しく反応して火災や爆発を引き起こす可能性があります。 KNO2 を取り扱うときは、保護具の使用、適切な換気、安全な保管などの適切な安全対策に従う必要があります。飲み込んだり吸入した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | Xn |
| セキュリティの説明 | S22、S24・25 |
| 国連識別番号 | 国連 1488 |
| HSコード | 2834.29.10 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅲ |
| 毒性 | 飲み込んだり吸入すると有害で、メトヘモグロビン血症を引き起こす可能性があります |
亜硝酸カリウムの合成法
水酸化カリウム(KOH)は亜硝酸(HNO2)と反応してKNO2を合成します。この反応により、副生成物として KNO2 と水 (H2O) が生成されます。産業界では、大量の KNO2 を製造するためにこの方法が一般的に使用されています。
反応式は次のとおりです。
2 KOH + HNO2 → KNO2 + 2 H2O
KNO2 を合成する別の方法は、炭酸カリウム (K2CO3)と一酸化窒素 (NO) を反応させることです。この反応により、副生成物として KNO2、二酸化炭素 (CO2)、および窒素 (N2) が生成されます。一酸化窒素の入手は難しく、高価であるため、この方法はあまり使用されません。
反応式は次のとおりです。
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
KNO2 は、SO2 や FeSO4 などの還元剤を使用して KNO3 を酸化することで得られます。
この反応では、KNO2、水、および還元型の還元剤が副生成物として生成されます。科学者がこの方法を使用する頻度は低く、通常は実験室での小規模な合成に使用されます。
二酸化硫黄との反応式は次のとおりです。
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
亜硝酸カリウムの用途
KNO2 は、その化学的特性により、いくつかの産業および実験室での用途があります。 KNO2 の一般的な用途には次のようなものがあります。
- 食品の保存: 有害な細菌の増殖を防ぎ、保存期間を延ばすために、塩漬け肉の防腐剤として使用されます。
- 化学産業: 亜硝酸、ジアゾニウム化合物、有機亜硝酸塩など、いくつかの化学物質の製造における中間体として使用されます。
- 農業: 水溶性が高く、窒素を放出する能力があるため、肥料や土壌改良剤として使用されます。
- 実験用試薬: 第一級アミンの検出やジアゾニウム塩の調製など、いくつかの実験室用途で試薬として使用されます。
- 医療用途: シアン化物イオンと反応して無毒のシアンメトヘモグロビンを生成するため、シアン化物中毒の治療に使用されます。
- 写真: 現像された画像の品質と鮮明さを向上させるために、写真現像剤の添加剤として使用されます。
- ガラス産業: ガラス産業では、ガラス製品から不要な着色を除去するための漂白剤として使用されます。
質問:
亜硝酸カリウムとは何ですか?
A: KNO2 は、さまざまな産業用途や実験室用途で一般的に使用される無機化合物です。
Q: 亜硝酸カリウムの式は何ですか?
A: 亜硝酸カリウムの化学式は KNO2 です。
Q: NH4OH が HNO3 と反応すると、どのような塩が生成されますか? KNO2、NaNO3、NH4NO3、またはNH4NO2?
A: NH4OH が HNO3 と反応すると、生成される塩は NH4NO3 です。
Q: KNO2 は酸ですか、それとも塩基ですか?
A: KNO2 は塩基性化合物です。
Q: 化学式 KNO2 を持つ化合物の名前は何ですか?
A: 化学式 KNO2 を持つ化合物の名前は亜硝酸カリウムです。
Q: KNO2 は弱塩基ですか?
A: KNO2 は弱塩基と考えられています。
Q: KNO2 は酸性ですか、それとも塩基性ですか?
A: KNO2 は本質的に塩基性であり、穏やかな還元剤として作用します。
