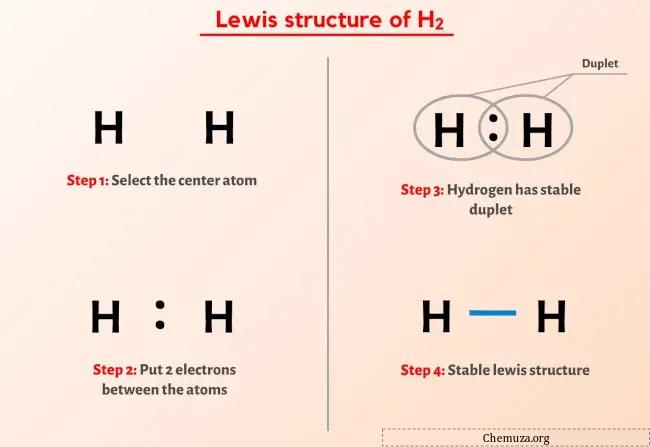
ルイス構造 H2 (二原子水素) は、2 つの水素 (H) 原子の間に単結合を持っています。
H2 のルイス構造の上の図から何も理解できなかった場合は、H2 のルイス構造の描画に関する詳細なステップバイステップの説明が表示されますので、そのままお付き合いください。
それでは、 H2のルイス構造を描画する簡単な手順に進みましょう。
H2 ルイス構造を描画する手順
ステップ 1: H2 分子内の価電子の総数を見つける
H2 分子内の価電子の総数を調べるには、まず単一の水素原子に存在する価電子を知る必要があります。
(価電子は、原子の最も外側の軌道に存在する電子です。)
ここでは、周期表を使って水素の価電子を簡単に求める方法を説明します。
H2 分子内の総価電子
→ 水素原子によって与えられる価電子:
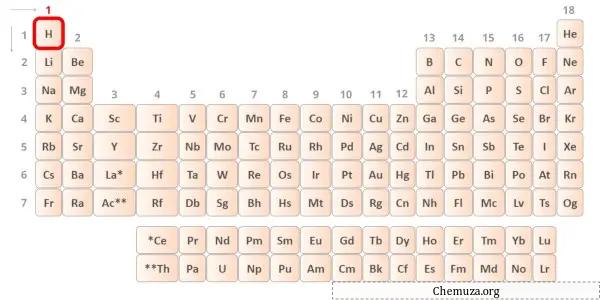
水素は周期表の第 1 族元素です。 [1]したがって、水素に存在する価電子は1です。

上の図に示すように、水素原子には価電子が 1 つだけ存在していることがわかります。
それで、
H2 分子内の総価電子 = 1(2) = 2 。
ステップ 2: スケッチを作成する
ルイス構造をスケッチするときは、電気陰性度の低い原子が中心に残ることを覚えておく必要があります。
ここで、与えられた分子は H2 (水素) です。両方の原子は同一であるため、いずれかの原子を中心原子として選択できます。

ステップ 3: 各原子の間に電子対を配置して各原子を接続する
ここで、H2 分子では、2 つの水素 (H) 原子の間に電子対を配置する必要があります。

これは、H2 分子内で 2 つの水素 (H) 原子が互いに化学結合していることを示しています。
ステップ 4: 原子を安定にする
ここの H2 分子の図では、水素原子が二重項を形成しており、したがって安定していることがわかります。
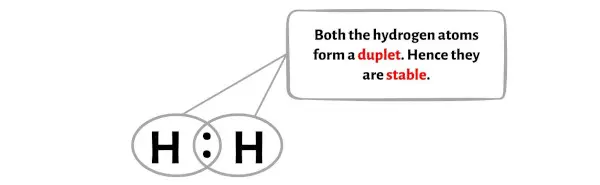
さらに、ステップ 1 では、H2 分子内に存在する価電子の総数を計算しました。
H2 分子には合計2 つの価電子があり、これら 2 つの価電子は上の H2 の図で使用されています。
上記の H2 のルイス ドット構造では、結合電子の各ペア (:) を単結合 (|) として表すこともできます。そうすると、H2 の次のルイス構造が得られます。
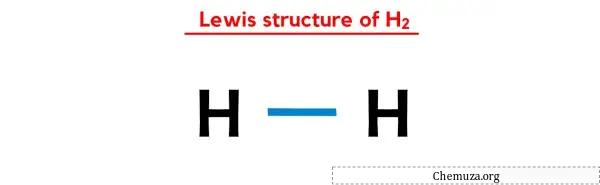
上記の手順をすべて完全に理解していただければ幸いです。
さらに練習して理解を深めたい場合は、以下にリストされている他のルイス構造を試してみてください。
理解を深めるために、次のルイス構造を試してください (または少なくとも見てください)。
