リン酸マグネシウム (Mg3(PO4)2) は、マグネシウムとリン酸イオンから構成される化合物です。 DNA合成、神経機能、筋肉収縮などの多くの生物学的プロセスにおいて重要な役割を果たしています。
| IUPAC名 | リン酸マグネシウム |
| 分子式 | Mg3(PO4)2 |
| CAS番号 | 7757-87-1 |
| 同義語 | リン酸三マグネシウム、オルトリン酸三マグネシウム、オルトリン酸マグネシウム、リン酸三マグネシウム、リン酸三マグネシウム |
| インチチ | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
リン酸マグネシウムの性質
リン酸マグネシウム配合
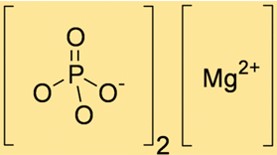
リン酸マグネシウムの化学式は Mg3(PO4)2 で、3 つの Mg+2 イオンと 2 つの PO43- イオンが含まれていることを示します。この式は化学量論計算に不可欠であり、Mg3(PO4)2 が関与する化学反応における反応物と生成物の正確な量を決定するのに役立ちます。
リン酸マグネシウムのモル質量
Mg3(PO4)2 のモル質量は 262.86 g/mol です。この値は、3 つの Mg+2 イオンと 2 つの PO4- イオンの組み合わせである化合物 Mg3(PO4)2 の 1 モルの質量を表します。モル質量は、さまざまな化学反応に必要な Mg3(PO4)2 の量を決定する化学量論計算で使用される重要な特性です。
リン酸マグネシウムの沸点
Mg3(PO4)2 は沸点に達する前に分解するため、定義された沸点がありません。高温では、Mg3(PO4)2 は酸化マグネシウムと五酸化リンに分解し、沸点はそれぞれ 3,600°C と 300°C になります。 Mg3(PO4)2 の分解温度は、濃度、加熱速度、圧力などのさまざまな要因に依存します。
リン酸マグネシウムの融点
Mg3(PO4)2 の融点は 1188°C です。この温度では、化合物は固体状態から液体状態に相変化します。 Mg3(PO4)2 の融点は、圧力、不純物、結晶構造などのさまざまな要因の影響を受けます。
リン酸マグネシウムの密度 g/mL
Mg3(PO4)2 の密度は結晶構造や測定条件によって異なります。 Mg3(PO4)2 の最も一般的な形態であるトリ-Mg3(PO4)2 の密度は 2.195 g/mL です。密度値は、さまざまな用途で特定の体積を達成するために必要な Mg3(PO4)2 の質量を決定するために不可欠です。
リン酸マグネシウムの分子量
Mg3(PO4)2 の分子量は 262.86 g/mol です。この値は、化合物中に存在する Mg イオンと PO43- イオンの原子量を加算することによって計算されます。 Mg3(PO4)2 の分子量は、さまざまな化学反応に必要な Mg3(PO4)2 の量を決定するのに役立ちます。
リン酸マグネシウムの構造
Mg3(PO4)2 は製造方法や条件によって結晶構造が異なります。最も一般的な形態はトリ-Mg3(PO4)2 で、六方格子に配置された Mg+2 イオンと PO43- イオンで構成される結晶構造を持っています。結晶構造は、Mg3(PO4)2 の物理的および化学的特性に影響を与えます。
| 外観 | 白色の結晶性粉末 |
| 比重 | 2.195 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 262.86 g/モル |
| 密度 | 2,195g/ml |
| 融合点 | 1188℃ |
| 沸点 | 沸点前に分解する |
| フラッシュドット | 適用できない |
| 水への溶解度 | 不溶性 |
| 溶解性 | 酸に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 7.2 |
| pH | 8-9 (10%溶液) |
リン酸マグネシウムの安全性と危険性
Mg3(PO4)2 は一般に安全で無毒であると考えられています。これは危険物質として分類されておらず、人間の健康や環境に重大なリスクをもたらすことはありません。ただし、高濃度の Mg3(PO4)2 粉塵に長時間さらされると、呼吸器への刺激を引き起こす可能性があります。大量の Mg3(PO4)2 を摂取すると、胃腸の炎症や吐き気を引き起こす可能性があります。 Mg3(PO4)2 を慎重に取り扱い、大量の化合物を取り扱う場合は適切な個人用保護具を着用することが重要です。こぼれたり漏れたりした場合は、滑ったり転んだりする危険を避けるために、すぐに掃除する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | 危険物として分類されていない |
| 国連識別番号 | 適用できない |
| HSコード | 2835.29.10 |
| 危険等級 | 未分類 |
| 梱包グループ | 適用できない |
| 毒性 | 通常の濃度では無毒 |
リン酸マグネシウムの合成法
Mg3(PO4)2 は、沈殿、酸化マグネシウムとリン酸の反応、水酸化マグネシウムとリン酸の反応など、いくつかの方法で合成できます。
沈殿プロセスには、Na3PO4 などの可溶性リン酸塩を、MgCl2 または硫酸マグネシウムなどの可溶性 Mg+2 塩を含む溶液に添加することが含まれます。次に、2 つの溶液を混合すると Mg3(PO4)2 の沈殿が生成され、これを収集して乾燥できます。
この反応には、リン酸溶液に酸化マグネシウムを加え、混合物を加熱して反応を完了させることが含まれます。次に、生成した Mg3(PO4)2 を収集して洗浄し、不純物を除去します。
この反応には、水酸化マグネシウムをリン酸溶液に加え、混合物を加熱して反応を完了させることが含まれます。次に、得られた Mg3(PO4)2 を収集し、完全に洗浄してすべての不純物を除去します。
原料の品質と反応条件に応じて、これらの方法を使用して、さまざまな純度の Mg3(PO4)2 を製造できます。
リン酸マグネシウムの用途
Mg3(PO4)2 は、さまざまな業界で次のような用途に使用されます。
- 食品産業: 酸度レベルを調整し、焼き菓子、乳製品、飲料の食感と品質を改善するための食品添加物として使用されます。
- 農業: マグネシウムやリンなどの必須栄養素を植物に提供する肥料として使用されます。
- 製薬産業: 消化不良や便秘の症状を緩和するために、制酸薬や下剤の有効成分として使用されます。
- 水処理: ボイラーやパイプ内のスケールの形成を制御し、腐食を防ぐための水処理薬品として使用されます。
- セラミック産業: セラミック製品の強度と耐久性を向上させるためのセラミックバインダーとして使用されます。
- 難燃剤: 断熱材、乾式壁、サイディングなどの建築材料の難燃剤として使用されます。
- 化粧品: 増粘剤および乳化剤として化粧品およびパーソナルケア製品に使用されます。
質問:
Q: Mg+2 イオンと PO43- イオンの間で形成される化合物の正しい式は何ですか?
A: Mg+2 イオンと PO43- イオンの間で形成される化合物の正しい式は、Mg3(PO4)2 です。
Q: リン酸マグネシウムの式は何ですか?
A: リン酸マグネシウムの化学式は Mg3(PO4)2 です。
Q: リン酸マグネシウムの 1 式単位を構成するイオンは何個ですか?
A: Mg3(PO4)2 の 1 つの式単位には 11 個のイオンが含まれます: 3 個の Mg+2 イオンと 2 個の PO43- イオン。
Q: リン酸マグネシウムは溶けますか?
A: Mg3(PO4)2 は水への溶解度が低く、室温での溶解度は約 0.1 g/100 mL です。
Q: 酸 (x) は塩基 (y) と反応して Mg3(PO4)2 を生成します。 x と y とは何ですか?
A: 酸 (x) はリン酸 (H3PO4)、塩基 (y) は水酸化マグネシウム (Mg(OH)2) です。
Q: 以前は制酸剤として薬用に使用されていた物質、Mg3(PO4)2 のモル質量はどれくらいですか?
A: Mg3(PO4)2 のモル質量は 262.86 g/mol です。
Q: Mg3(PO4)2 は水に溶けますか?
A: Mg3(PO4)2 は水への溶解度が低く、室温での溶解度は約 0.1 g/100 mL です。
Q: 1 モルの Mg3(PO4)2 には何モルの酸素原子が含まれていますか?
A: 1 モルの Mg3(PO4)2 には 8 モルの酸素原子が含まれています。
